ビタミンDは乳がんのホルモン依存性を高める
ビタミンDは乳がんのホルモン依存性を高める
ビタミンDがエストロゲン非依存性の乳がんをエストロゲン依存性に変換するという報告があります。
Calcitriol restores antiestrogen responsiveness in estrogen receptor negative breast cancer cells: A potential new therapeutic approach(カルシトリオールはエストロゲン受容体陰性の乳がん細胞の抗ホルモン療法感受性を高める:新しい治療法の可能性)BMC Cancer 2014, 14:230 http://www.biomedcentral.com/1471-2407/14/230
乳がんの約30%はエストロゲン受容体を発現していません。エストロゲン受容体陰性の乳がんはホルモン療法が効きません。
カルシトリオール(Calcitriol)は活性型ビタミンD3の1α,25-ジヒドロキシ・ビタミンD3です。
エストロゲン受容体陰性の乳がん細胞を使った実験で、活性型ビタミンD3のカルシトリオールがエストロゲン受容体の遺伝子発現を誘導して、抗エストロゲン剤による抗腫瘍効果が得られるようになったという結果を報告しています。
抗エストロゲン剤の効き目を高める目的でビタミンD3のサプリメントを多く摂取するメリットはあるようです。
ビタミンD3には様々な抗腫瘍効果が報告されています(詳しくはこちらへ)。
抗がん剤やホルモン療法との併用も問題なく、これらの抗腫瘍効果を高める効果は十分に期待できます。1日4000 IU(100μg)程度のビタミンD3をサプリメントで摂取することはがん治療に有効だと言えます。
また、ビタミンD受容体はレチノイドX受容体とヘテロ2量体を形成して転写活性を持つので、レチノイドX受容体のリガンドになるイソトレチノイン(13-cisレチノイン酸)の併用は有効です。糖尿病治療薬のメトホルミンやラパマイシンとの併用も有効です。(詳しくはこちらへ)。
◎ ビタミンD3のサプリメントはこちらへ:
高濃度ビタミンC点滴はがん細胞のDNAを損傷し、NAD+とATPを枯渇して、細胞死を誘導する。
高濃度ビタミンC点滴はがん細胞のDNAを損傷し、NAD+とATPを枯渇して、細胞死を誘導する。
Pharmacologic ascorbate induces neuroblastoma cell death by hydrogen peroxide mediated DNA damage and reduction in cancer cell glycolysis.(薬理学的アスコルビン酸は過酸化水素介在性のDNA損傷とがん細胞の解糖系の抑制によって神経芽細胞腫に細胞死を誘導する)Free Radic Biol Med. 2017 Dec;113:36-47.
【要旨】
アスコルビン酸は酸化ストレスを高め、腫瘍の増殖を遅らせることが示されている。この作用において、解糖系の抑制が起こることが推測されている。この研究では、この観察に関連するメカニズムをさらに検討した。
アスコルビン酸は過酸化水素を産生し、その結果、ATP枯渇とGAPDH(グリセルアルデヒド-3-リン酸デヒドロゲナーゼ)の阻害を引き起こして、ヒト神経芽細胞腫を死滅させる作用を示し、アポトーシスやオートファジーによる細胞死とは異なるタイプの細胞死を引き起こす。
細胞傷害性の機序は、PARP(ポリADPリボースポリメラーゼ)依存性DNA修復機構が活性化される場合と阻害された場合では異なっていた。
アスコルビン酸によって生成された過酸化水素はDNAを損傷し、PARPを活性化し、酸化型NAD(NAD+)を枯渇し、解糖系を阻害した。
NAD+の補給は、ATP枯渇および細胞死を防止した。一方、PARP阻害剤のオラパリブ(olaparib)での処理は、NAD+およびATPレベルを維持したが、DNA二本鎖切断の増加をもたらし、アスコルビン酸誘発性細胞死を防止しなかった。
これらの実験結果は、正常なPARP関連DNA修復システムを有する細胞においては、アスコルビン酸誘導性細胞死はNAD+およびATP枯渇によって引き起こされるが、PARP活性が阻害された条件では、アスコルビン酸誘導性の細胞死は起こるが、それは活性酸素種によるDNA損傷の結果である。
マウス異種移植モデルでは、腹腔内に投与したアスコルビン酸は神経芽細胞腫の増殖を抑制し、生存期間を延長した。
以上をまとめると、これらのデータは、アスコルビン酸が解糖依存性腫瘍の治療に有効であり得ることを示唆している。また、解糖系以外の代替エネルギー代謝経路を使用するがんでは、PARP阻害剤をアスコルビン酸治療と組み合わせることが有用である。
【解説】
ビタミンCはグルコースと構造が似ており、同じ糖輸送担体(グルコーストランスポーター)によって細胞内に取込まれます。がん細胞はグルコーストランスポーターの発現量が増え、グルコースの取込みが亢進しているので、大量のビタミンCががん細胞に取込まれ、がん細胞が選択的に死滅させることができます。
提唱されている作用機序として、ビタミンCによって発生した過酸化水素(H2O2)がDNAにダメージを与えると、ポリADPリボース合成酵素(PARP)が活性化されNAD+が枯渇し、解糖系もTCA回路も進まなくなります。活性酸素はミトコンドリアにもダメージを与えます。これらの作用で、エネルギーが枯渇して細胞が死滅することになります。この作用機序を下図にまとめています。
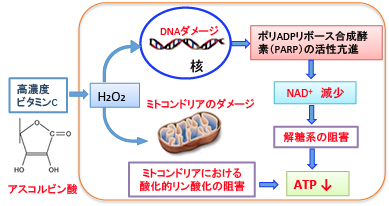
図:ビタミンCはグルコーストランスポーターから細胞内に取込まれる。がん細胞はグルコーストランスポーターの発現量が増えているので、がん細胞に高濃度のビタミンCが取込まれる。取込まれたビタミンCはがん細胞内で過酸化水素(H2O2)を発生させて、DNAとミトコンドリアにダメージを与える。DNAのダメージはポリADPリボース合成酵素(PARP)の活性を亢進してNAD+(ニコチンアミドアデニンジヌクレオチド)が減少すると解糖系が阻害される。ミトコンドリアのダメージは酸化的リン酸化でのATP産生を減少させる。この結果、がん細胞内のATPが枯渇してがん細胞は死滅する。
また、PARP阻害剤のオラパリブ(olaparib)と高濃度ビタミンC点滴の併用が有効であることが示唆されます。
高濃度ビタミンC点滴についてはこちらへ:
http://www.1ginzaclinic.com/vitamin.html
【原文】
Free Radic Biol Med. 2017 Dec;113:36-47.
Pharmacologic ascorbate induces neuroblastoma cell death by hydrogen
peroxide mediated DNA damage and reduction in cancer cell glycolysis.
Ma E, Chen P, Wilkins HM, Wang T, Swerdlow RH, Chen Q.
Abstract
An ascorbate-mediated production of oxidative stress has been shown to retard tumor growth. Subsequent glycolysis inhibition has been suggested. Here, we further define the mechanisms relevant to this observation. Ascorbate was cytotoxic to human neuroblastoma cells through the production of H2O2, which led to ATP depletion, inhibited GAPDH, and non-apoptotic and non-autophagic cell death. The mechanism of cytotoxicity is different when PARP-dependent DNA repair machinery is active or inhibited. Ascorbate-generated H2O2 damaged DNA, activated PARP, depleted NAD+, and reduced glycolysis flux. NAD+ supplementation prevented ATP depletion and cell death, while treatment with a PARP inhibitor, olaparib, preserved NAD+ and ATP levels but led to increased DNA double-strand breakage and did not prevent ascorbate-induced cell death. These data indicate that in cells with an intact PARP-associated DNA repair system, ascorbate-induced cell death is caused by NAD+ and ATP depletion, while in the absence of PARP activation ascorbate-induced cell death still occurs but is a consequence of ROS-induced DNA damage. In a mouse xenograft model, intraperitoneal ascorbate inhibited neuroblastoma tumor growth and prolonged survival. Collectively, these data suggest that ascorbate could be effective in the treatment of glycolysis-dependent tumors. Also, in cancers that use alternative energy metabolism pathways, combining a PARP inhibitor with ascorbate treatment could be useful.
漢方治療はがん患者の生存率を高める
漢方治療はがん患者の生存率を高める
台湾におけるがん治療における中医薬(漢方薬)治療の実態に関して多くの報告があります。
以下の論文では漢方治療を受けたがん患者は漢方治療を受けなかったがん患者より生存率が高いことが報告されています。
Use
of Complementary Traditional Chinese Medicines by Adult Cancer Patients in
Taiwan: A Nationwide Population-Based Study(台湾における成人がん患者による伝統的中医薬の補完的使用:全国民ベースの研究)Integr
Cancer Ther. 2018 Jun; 17(2): 531-541.
【要旨】
研究の背景:がん患者の多くは、補完的な代替医療を求めている。台湾の成人がん患者による伝統的な中医薬(漢方薬)の使用を調査した。
方法: 台湾の難治性疾患患者登録データベース(Registry for
Catastrophic Illness Patients Database)を調査し、国際疾病分類(第9改正)に基づいて、2001年から2009年までのがんと診断された全ての成人を対象にして、2011年まで追跡調査した。このデータベースにより、中医薬使用者(n=74620)と非使用者(n = 508179)を分類できた。すべての人口統計学的および臨床的なデータが分析された。
結果: 中医薬を使用していないがん患者と比較して、中医薬を使用しているがん患者は、より若く、女性とホワイトカラーの労働者(頭脳労働をする人)が多い傾向にあり、さらに高度に都市化の進んだ地域(highly
urbanized areas)に住んでいる人が多かった。
がんの診断を受けてから中医学のクリニックに相談に行くまでの平均間隔は15.3ヶ月であった。
最も多いがんの種類は、中医薬使用者では乳がん(19.4%)であり、中医薬非使用者では肝内胆管がん(13.6%)であった。
中医薬使用者が中医学の診療所を訪れた主な理由は、内分泌系異常、栄養障害および代謝性疾患、免疫障害であった。
中医薬使用者の33.1%が年間に9回以上中医学診療所を訪問し、がんの診断から最初に中医学治療の相談に行くまでの期間の平均は5.14ヶ月であった。
中医学的治療のうち最も多かったのは中医薬(漢方薬)であった。
がん患者が中医学的治療を求めた理由は、不眠、倦怠感・疲労、めまい・頭痛、胃腸障害、筋肉痛・筋膜炎、不安・うつ病であった。
年齢、性別、居住地の都市化、職業、医療期間への訪問回数、および非医療関係のセンターの訪問を調整後の解析で、中医薬非使用者に比べて中医薬使用者の死亡率は低く、その死亡率の調整ハザード比は0.69(95%信頼区間 = 0.68-0.70)であった。
結論:本研究では、台湾の成人がん患者における中医薬(漢方薬)使用の概要を提供している。 中医薬の使用は、がんの種類の違いによって様々であった。がん患者を診療する医師は、患者が使用している補完的な中医薬(漢方薬)の使用にもっと注意を払うべきである。
【解説】
情報技術の進歩により、今やビッグデータの時代と言われています。医療の疫学研究でも医療ビッグデータを利用した研究が増えています。
台湾では、1995年に国民皆保険制度を実現しています。
台湾の医療制度は、「全民健康保険(National Health Insurance)」という台湾政府が管理するシステムで、台湾で戸籍を持つ全ての人に対して平等な医療ケアを提供するために作られました。国民全員を加入対象とした完全な社会保険制度で、国民全員が出生した時点で、平等に医療を受ける権利を享受できできます。
健康保険証はICカードのみで、医療事務の電子システム化が進んでおり、オンライン請求率は2006年には99.98%に達しています。
このような状況で、台湾では国民全体の医療情報(年齢、性別、病名、治療内容など)がデータベース化されています。この「全民健康保険研究データベース(National health insurance research database;
NHIRD)」を使った疫学研究が台湾から数多く発表されています。
がんの場合はNHIRDの中に「難治性疾患患者登録データベース(Registry for Catastrophic Illness Patients
Database)」というデータベースもあります。
台湾の全民健康保険(National Health Insurance)では、がん患者は西洋医学の標準治療だけでなく、中医学治療(漢方治療)も保険給付され、それらの情報がデータベース化されています。したがって、漢方治療を受けたがん患者と漢方治療を受けなかったがん患者で、生存率や生存期間の比較も可能になっています。
ハザード比(Hazard ratio)というのは追跡期間を考慮したリスクの比です。この論文のリスクは死亡率です。
この報告において、漢方薬非使用群に対する漢方薬使用群の死亡率のハザード比が0.69というのは、追跡期間中に漢方薬を服用したがん患者は漢方薬を服用しなかったがん患者に比べて死亡率が31%減少したという意味になります。
95%信頼区間とは,仮に同様な試験を100回した場合に95回はこの値の幅の中に入るという意味です。95%信頼区間 = 0.24-0.45というのは、同様な試験を100回行なえば、95回はハザード比が0.24-0.45の間に入ることを意味します。つまり、漢方薬ががん患者を延命させる可能性は極めて高いという結果です。
漢方薬を使用する人は女性が多く、都市化の進んだ地域に住んでいる人が多いという結果が得られています。
都市の方が漢方薬などの中医学治療を行なっている医療機関が多いというアクセスの良さが理由のようです。田舎では中医学のクリニックが無いということです。
都市化が進んだ地域は、生活環境や医療環境も良いので、それが生存率に影響する可能性があります。また、女性は男性よりも寿命が長いので、女性が多いことが生存率の高さに影響する可能性もあります。
そこで、このような交絡因子(調べようとする因子以外の因子で、病気や死亡の発生に影響を与えるもの)の影響をさける目的で、年齢、性別、居住地の都市化、職業、医療期間への訪問回数、および非医療関係のセンターの訪問を調整後のハザード比を計算しています。
その結果、漢方薬服用はがん患者の死亡率を30%くらい低下させるという結果が得られたということです。
【原文】
Integr
Cancer Ther. 2018 Jun;17(2):531-541. doi:
10.1177/1534735417716302. Epub 2017 Jun 30.
Use of Complementary Traditional Chinese Medicines by Adult Cancer Patients in
Taiwan: A Nationwide Population-Based Study.
Kuo YT1,2, Chang TT1,3, Muo CH4, Wu MY3, Sun MF1,3, Yeh CC2,5, Yen HR1,3,6.
Abstract
BACKGROUND:
Many patients with cancer
seek complementary and alternative medicine treatments. We investigated the use
of traditional Chinese medicine (TCM) by adult cancer patients in Taiwan.
METHODS:
We reviewed the Registry
for Catastrophic Illness Patients Database of Taiwan, and included all adult
patients diagnosed cancer, based on the International Classification of
Diseases (ninth revision), from 2001 to 2009 and followed until 2011. This
database allowed categorization of patients as TCM users (n = 74 620) or non-TCM
users (n = 508 179). All demographic and clinical claims data were analyzed.
RESULTS:
Compared with non-TCM
users, TCM users were younger and more likely to be female, white-collar
workers, and reside in highly urbanized areas. The average interval between
cancer diagnosis and TCM consultation was 15.3 months. The most common cancer
type was breast cancer in TCM users (19.4%), and intrahepatic bile duct cancer
in non-TCM users (13.6%). The major condition for which TCM users visited
clinics were endocrine, nutritional and metabolic diseases, and immunity
disorders (23.2%). A total of 33.1% of TCM users visited TCM clinics more than
9 times per year and their time from diagnosis to first TCM consultation was
5.14 months. The most common TCM treatment was Chinese herbal medicine. The
common diseases for which cancer patients sought TCM treatment were insomnia,
malaise and fatigue, dizziness and headache, gastrointestinal disorders,
myalgia and fasciitis, anxiety, and depression. Overall, TCM users had a lower
adjusted hazard ratio (aHR) for mortality (aHR = 0.69, 95% CI = 0.68-0.70)
after adjustment for age, sex, urbanization of residence, occupation, annual
medical center visits, and annual non-medical center visits.
CONCLUSIONS:
This study provides an overview of TCM usage among adult cancer patients in Taiwan. TCM use varied among patients with different types of cancer. Physicians caring for cancer patients should pay more attention to their patients' use of complementary TCM.
漢方治療は膵臓がん患者の生存率を高める
漢方治療は膵臓がん患者の生存率を高める
台湾の医療ビッグデータを利用した疫学研究で、膵臓がん患者で漢方薬(中医薬)を使用した患者は、漢方薬を使用しなかった患者よりも生存率が高いことが示されています。漢方治療の期間が長いほど生存率が高いという用量依存性も示されています。以下のような報告があります。
Complementary Chinese Herbal Medicine Therapy Improves Survival of Patients With Pancreatic Cancer in Taiwan: A Nationwide Population-Based Cohort Study.(台湾において補完的な漢方治療は膵臓がん患者の生存率を高める:全国人口レベルのコホート研究)Integr Cancer Ther. 2018 Jun; 17(2): 411-422.
【要旨】背景:膵臓がんは治療が困難ながんであり、発見が遅れることが多く、予後は不良である。一部の患者は伝統的な中国医学の治療を受けている。我々は、台湾の膵臓がん患者における補完的な漢方薬治療の利点を調べることを目指した。
方法:1997年から2010年に台湾難治性疾患患者登録データベース(Taiwanese Registry for Catastrophic Illness Patients Database)に登録された全ての膵臓がん患者を対象とした。年齢、性別、膵臓がんと診断された年を一致させた1:1マッチング法を用いて、漢方治療を併用した386人と、漢方治療を併用しない386人を比較解析した。死亡リスクの危険率(ハザード比)はCox回帰モデルを用いて比較した。生存期間の差はKaplan-Meier曲線を用いて比較した。
結果:漢方薬の使用、年齢、性別、都市化レベル、他の病気の有無および治療に関して相互に調整されたCoxハザード比モデルによる解析で、漢方治療を受けた患者は死亡リスクのハザード比が低かった(調整ハザード比 = 0.67,95%信頼区間 = 0.56-0.79)。 漢方療法を90日間以上受けた患者は、漢方治療を受けなかった患者よりも死亡リスクのハザード比が有意に低かった。漢方治療を90〜180日間受けた群では、調整後ハザード比 = 0.56(95%信頼区間 = 0.42〜0.75)で、180日間以上漢方治療を受けた群では ハザード比= 0.33(95%信頼区間 = 0.24-0.45)であった。 漢方薬併用群の患者の生存率は高かった。
患者が使用した生薬と漢方方剤で最も頻度が高かったのは、単一の生薬では白花蛇舌草で、漢方処方では香砂六君子湯であった。
結論:補完的な中国薬草療法(漢方治療)は、膵臓がん患者の死亡率を低下させる可能性がある。今後はさらに前向き臨床試験によってこの結果を確認する必要がある。
【解説】
漢方薬(中医薬)治療を受けた期間が長いほど延命効果があるという結果です。
漢方処方では香砂六君子湯(こうしゃりっくんしとう)が多く、単一の生薬では白花蛇舌草の使用頻度が高いという膵臓がんの漢方治療の特徴を明らかにしています。
香砂六君子湯は、胃腸虚弱で消化管に水分が停滞しやすいタイプに用いる六君子湯(人参、白朮、茯苓、大棗、甘草、生姜、半夏、陳皮)に、さらに胃腸の機能を高め、食欲を亢進し、気分の塞さがりを開く働きがある香附子、縮砂、藿香を加えた処方です。六君子湯に抗うつ作用を加えた処方といえます。
香附子・縮砂・藿香は香りが良く、気の巡りを改善し、気うつの症状(気分が沈む、気分が塞がる、意気消沈する精神状態)を改善します。
膵臓がんでは胃腸の働きが低下し、食欲が低下します。さらにうつ症状を呈することが多く経験されます。したがって、進行した膵臓がん患者さんは香砂六君子湯の証が多くなるのかもしれません。
白花蛇舌草は抗がん作用のある生薬です。
白花蛇舌草の煎じ薬は、肝臓の解毒作用を高めて血液循環を促進し、白血球・マクロファージなどの食細胞の機能を著しく高め、リンパ球の数や働きを増して免疫力を高めます。多くのがんに広く使用され、良い治療効果が報告されています。 飲み易く刺激性が少ないので、食欲が低下した進行がんにも適しています。
漢方治療は膵臓がんの抗がん剤治療の副作用軽減と抗腫瘍効果増強に有効です。
その結果、QOL(生活の質)を高め、延命します。
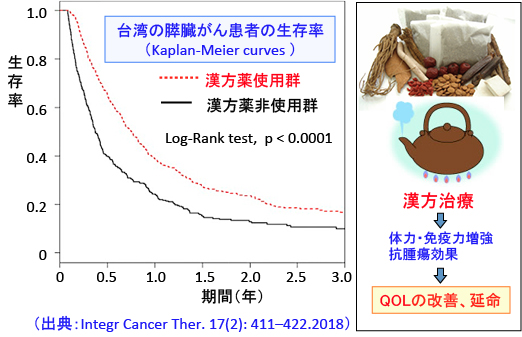
図:(右)漢方治療は体力・免疫力を増強する効果と直接的な抗腫瘍作用(がん細胞の増殖抑制、アポトーシス誘導など)によって、QOL(生活の質)の改善と延命効果がある。
(左)台湾の医療ビッグデータを利用した疫学研究で、膵臓がん患者で漢方薬(中医薬)を使用した患者は、漢方薬を使用しなかった患者よりも生存率が高いことが示されている。漢方治療の期間が長いほど生存率が高いという用量依存性も示されている。
【原文】
Integr Cancer
Ther. 2018 Jun;17(2):411-422. doi: 10.1177/1534735417722224. Epub 2017 Aug 3.
Complementary Chinese Herbal Medicine Therapy Improves Survival of Patients
With Pancreatic Cancer in Taiwan: A Nationwide Population-Based Cohort Study.
Abstract
BACKGROUND:
Pancreatic cancer is a difficult-to-treat cancer with a late presentation and poor prognosis. Some patients seek traditional Chinese medicine (TCM) consultation. We aimed to investigate the benefits of complementary Chinese herbal medicine (CHM) among patients with pancreatic cancer in Taiwan.
METHODS:
We included all patients with pancreatic cancer who were registered in the Taiwanese Registry for Catastrophic Illness Patients Database between 1997 and 2010. We used 1:1 frequency matching by age, sex, the initial diagnostic year of pancreatic cancer, and index year to enroll 386 CHM users and 386 non-CHM users. A Cox regression model was used to compare the hazard ratios (HRs) of the risk of mortality. The Kaplan-Meier curve was used to compare the difference in survival time.
RESULTS:
According to the Cox hazard ratio model mutually adjusted for CHM use, age, sex, urbanization level, comorbidity, and treatments, we found that CHM users had a lower hazard ratio of mortality risk (adjusted HR = 0.67, 95% CI = 0.56-0.79). Those who received CHM therapy for more than 90 days had significantly lower hazard ratios of mortality risk than non-CHM users (90- to 180-day group: adjusted HR = 0.56, 95% CI = 0.42-0.75; >180-day group: HR = 0.33, 95% CI = 0.24-0.45). The survival probability was higher for patients in the CHM group. Bai-hua-she-she-cao (Herba Oldenlandiae; Hedyotis diffusa Spreng) and Xiang-sha-liu-jun-zi-tang (Costus and Chinese Amomum Combination) were the most commonly used single herb and Chinese herbal formula, respectively.
CONCLUSIONS:
Complementary
Chinese herbal therapy might be associated with reduced mortality among
patients with pancreatic cancer. Further prospective clinical trial is
warranted.
ジクロロ酢酸とCOX-2阻害剤のセレコックス(celecoxib)の併用は相乗的な抗腫瘍効果を示す
ジクロロ酢酸とCOX-2阻害剤のセレコックス(celecoxib)の併用は相乗的な抗腫瘍効果を示す
Inhibition of COX2 enhances the chemosensitivity of dichloroacetate in cervical cancer cells(シクロオキシゲナーゼ2の阻害は子宮頚がん細胞におけるジクロロ酢酸の感受性を増強する)Oncotarget. 2017 Aug 1; 8(31): 51748-51757.
【要旨】
ミトコンドリア機能を高めるジクロロ酢酸は、子宮頚がんを含む多くの悪性腫瘍の治療において、抗がん剤感受性を高める増感剤として有望な可能性を示している。しかし、子宮頚がんに対するジクロロ酢酸単独の効果については不明である。
さらに、以前の報告は、シクロオキシゲナーゼ-2(COX2)発現の増加が、化学療法抵抗性および子宮頚がんの予後不良と関連することを実証している。しかし、COX2が子宮頚がん細胞におけるジクロロ酢酸の感受性に影響を与えるかどうかは依然として不明である。
この研究では、子宮頚がん細胞がジクロロ酢酸に対して感受性が無いことがわかった。さらに、ジクロロ酢酸が子宮頚がん細胞のCOX-2の発現を亢進し、子宮頸がん細胞におけるジクロロ酢酸の化学感受性を妨げていることを初めて明らかにした。
メカニズムに関する研究は、ジクロロ酢酸がRNA
binding protein quaking(QKI)のレベルを低下させ、COX2 mRNAの分解を抑制してCOX2タンパク質の増加を引き起こすことを示した。
COX2阻害剤のセレコキシブの併用は、インビトロおよびインビボの両方の実験系でジクロロ酢酸に対する子宮頚がん細胞の感受性を高め、子宮頸がん細胞の増殖を抑制した。
これらの結果は、COX2がジクロロ酢酸の新規な抵抗因子であり、セレコキシブとジクロロ酢酸との組み合わせが子宮頚がんの治療に有益であり得ることを示している。
【解説】
RNA binding protein quaking(QKI)はRNA結合タンパク質であり、mRNA前駆体のスプライシング、mRNAの輸送、安定性、翻訳、miRNAのプロセシング、環状RNAの形成などに関与しています。
ジクロロ酢酸は子宮頚がん細胞にアポトーシスを誘導できますが、ジクロロ酢酸はCOX2の発現を増加し、COX-2は子宮頚がん細胞のジクロロ酢酸に対する感受性を低下させます。ジクロロ酢酸はCOX2のmRNAの安定性を亢進して、COX2たんぱく質を増やすからです。
そのため、COX2阻害剤のcelecoxibは、ジクロロ酢酸の抗腫瘍効果を高めることができるのです。
つまり、子宮頚がんを含めて、抗がん剤に対するがん細胞の感受性を高める目的でジクロロ酢酸を併用するときにはシクロオキシゲナーゼ-2(COX-2)阻害剤のcelecoxib(商品名:セレコックス)を併用するのが良いと言えます。
原文:
Oncotarget. 2017 Jun 16;8(31):51748-51757. doi:
10.18632/oncotarget.18518. eCollection 2017 Aug 1.
Inhibition of COX2 enhances the chemosensitivity of dichloroacetate in cervical cancer cells.
Abstract
Dichloroacetate (DCA), a traditional mitochondria-targeting agent, has shown promising prospect as a sensitizer in fighting against malignancies including cervical cancer. But it is unclear about the effect of DCA alone on cervical tumor. Moreover, previous reports have demonstrated that the increased cyclooxygenase-2 (COX2) expression is associated with chemoresistance and poor prognosis of cervical cancer. However, it is still unknown whether COX2 can affect the sensitivity of DCA in cervical cancer cells. In this study, we found that cervical cancer cells were insensitive to DCA. Furthermore, we for the first time revealed that DCA could upregulate COX2 which impeded the chemosensitivity of DCA in cervical cancer cells. Mechanistic study showed that DCA reduced the level of RNA binding protein quaking (QKI), leading to the decay suppression of COX2 mRNA and the subsequent elevation of COX2 protein. Inhibition of COX2 using celecoxib could sensitize DCA in repressing the growth of cervical cancer cells both in vitro and in vivo. These results indicate that COX2 is a novel resistance factor of DCA, and combination of celecoxib with DCA may be beneficial to the treatment of cervical cancer.
ビタミンDは、トリプル・ネガティブ乳がんのがん幹細胞を阻害し、分化を誘導する。
ビタミンDは、トリプル・ネガティブ乳がんのがん幹細胞を阻害し、分化を誘導する。
Vitamin D compounds inhibit
cancer stem-like cells and induce differentiation in triple negative breast
cancer.(ビタミンD化合物は、トリプル・ネガティブ乳がんにおいて
がん幹細胞様細胞を阻害し、分化を誘導する。)J Steroid Biochem Mol Biol. 2017
Oct;173:122-129.
【要旨】
トリプル・ネガティブ乳がんは、ホルモン受容体を持たず、悪性度が高く、再発率が高いという特徴を有しており、現在利用可能な標的療法に対する反応性が最も低い乳がんサブタイプの1つである。
したがって、早い段階からの乳がんの発生予防は、トリプル・ネガティブ乳がんの進行を遅延させる上で重要な役割を果たす可能性がある。
がん幹細胞は、腫瘍の進行、治療抵抗性および転移の原因と考えられるがん細胞である。
我々は以前に、ジェミニ・ビタミンD類似体BXL0124(Gemini
vitamin D analog BXL0124)を含むビタミンD化合物が、生体内(in vivo)で上皮内腺管がんの進行を抑制し、MCF10DCIS乳がん細胞のマンモスフェア培養においてがん幹細胞様細胞を阻害することを示した。
本研究では、トリプル・ネガティブ乳がんにおける乳がん幹細胞様細胞の増殖と分化に対するビタミンD化合物の作用を検討した。
がん幹細胞様の性質を有する乳がん細胞を増やすマンモスフェア培養(Mammosphere cultures)を用いて、トリプル・ネガティブ乳がん細胞株SUM159のがん幹細胞マーカーに対する 1α,25(OH)2ビタミンD3 およびBXL0124の効果を評価した。
ビタミンD化合物は、対照群と比較して、マンモスフェア培養の一次、二次、および三次継代におけるマンモスフィア(がん細胞塊)形成効率を有意に低下させた。
1α,25(OH)2ビタミンD3 およびBXL0124で処理されたマンモスフェアにおいて、がん幹細胞様表現型および多能性の主要マーカーが分析された。その結果、OCT4、CD44およびLAMA5レベルの減少を認めた。
ビタミンD化合物はまた、乳がん幹細胞の維持に関与するNotchシグナル伝達分子、Notch1、Notch2、Notch3、JAG1、JAG2、HES1およびNFκBの発現レベルを低下した。
さらに、ビタミンD化合物は、筋上皮細胞の分化マーカーであるサイトケラチン14および平滑筋アクチンの発現を亢進し、腺管細胞のマーカーであるサイトケラチン18の発現を抑制した。
基底様乳がんに関連するバイオマーカーであるサイトケラチン5は、ビタミンD化合物によって発現レベルが有意に抑制された。
これらの結果は、ビタミンD化合物が、がん幹細胞および分化を制御することによってトリプル・ネガティブ乳がんを阻害する潜在的な予防剤として役立つことを示唆している。
ビタミンDの血中濃度が高いほど、乳がんの生存率が良くなることが大規模疫学研究で明らかになっています。
トリプル・ネガティブ乳がんでは特に血中ビタミンD濃度が低いというデータが報告されています。
Triple negative breast
cancer patients presenting with low serum vitamin D levels: a case series(血清ビタミンD濃度が低値を示すトリプル・ネガティブ乳がん:ケースシリーズ)Cases J. 2009; 2: 8390.
一般にがん患者は血清中のビタミンD濃度(貯蔵型の25-ヒドロキシビタミンDで測定)が低値を示すことが明らかになっています。この論文では15例のトリプル・ネガティブ乳がんを対象に25-ヒドロキシビタミンDの血清中の濃度を測定し、健常人や他のサブタイプの乳がん患者と比較しています。
解析の結果、トリプル・ネガティブ乳がん患者では特にビタミンDの血清中濃度が低いという結果を示しています。トリプル・ネガティブ乳がん患者は積極的にビタミンDのサプリメントを補充することが有用と言えます。
再発予防や進行乳がんでビタミンD3のサプリメントの大量摂取が代替医療ではポピュラーです。以下のような症例報告があります。
Effects of Pre-surgical
Vitamin D Supplementation and Ketogenic Diet in a Patient with Recurrent Breast
Cancer.(再発乳がん患者における術前のビタミンD補充とケトン食の効果)Anticancer Res. 2015 Oct;35(10):5525-32.
この患者の術前の生検による病理検査では、プロゲステロン受容体(PgR)の発現は少なく(10%,
score 2+)、増殖活性を示す核タンパク質Ki67は強陽性(30%)でした。
診断から手術まで3週間あり、その間の治療の計画が無かったので、患者は自分の判断で、ビタミンD3(1日10,000 IU)と厳格なケトン食を実施しました。
乳房切除を行われ、切除組織の病理検査でHER2の発現は全く認めず(陰性、score 0)で、PgRの発現は亢進していました(20%)。ERとKi67の陽性度は変化はありませんでした。
この症例は、高用量のビタミンD3とケトン食の併用は、乳がん細胞のHER2発現を抑制し、プロゲステロン受容体の発現を亢進するなど、乳がん細胞の生物学的性状に影響を及ぼす可能性を示唆しています。
この論文は1例の症例報告ですので、高用量のビタミンD3とケトン食の併用が乳がんに有効かどうかのエビデンスは低いのですが、高用量のビタミンD3とケトン食はそれぞれ乳がんに対する効果が報告されているので、この2つの治療の併用を試してみる価値はあるかもしれません。
また、ビタミンD3とメトホルミンの相乗効果は乳がんや前立腺がんや大腸がんなどで報告されています。メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化してAkt/mTORシグナル伝達系を阻害し、がん細胞の増殖を抑制します。
ビタミンD3はメトホルミンの抗腫瘍効果を高めます。次のような報告があります。
Synergistic antitumor activity of vitamin D3 combined
with metformin in human breast carcinoma MDA-MB-231 cells involves mTOR related
signaling pathways. (ヒト乳がん細胞MDA-MB-231細胞におけるビタミンD3とメトホルミンの併用による相乗的な抗腫瘍効果はmTOR関連のシグナル伝達系が関与する)Pharmazie. 2015 Feb;70(2):117-22.
メトホルミンは2型糖尿病の治療に使用されていますが、最近の多くの研究によって、メトホルミンとビタミンDは多くのがん細胞に対して抗腫瘍効果を示すことが示されています。
この研究では、ヒト乳がん細胞株MDA-MB-231を用いて、ビタミンD3とメトホルミンの併用はアポトーシス誘導において相乗効果があることを報告しています。その抗腫瘍効果の発現にはmTOR関連のシグナル伝達系が関与することを報告しています。
つまり、ビタミンD3とメトホルミンはmTOR(哺乳類ラパマイシン標的蛋白質)の活性を阻害することによってアポトーシスを誘導することを示しています。
前立腺がんや大腸がんでも同様の効果が報告されています。
メトホルミンはAMP依存性プロテインキナーゼ(AMPK)を活性化し、活性化してAMPKはmTORを抑制することによって、がん細胞の増殖を抑制します。 以下のような報告もあります。
Combined use of vitamin D3
and metformin exhibits synergistic chemopreventive effects on colorectal
neoplasia in rats and mice. (ビタミンD3とメトホルミンの併用はラットとマウスの結腸直腸がんの発生に対して相乗的な化学予防効果を示す)Cancer Prev Res
(Phila). 2015 Feb;8(2):139-48.
この研究はラットとマウスを用いた大腸発がん実験での検討です。メトホルミンは化学発がんモデルで大腸がんの発生を抑制する作用があります。ビタミンD3はメトホルミンの発がん抑制作用を増強するという結果です。
そのメカニズムとして、mTOR活性の抑制を認めています。さらに、ビタミンD3にはビタミンD受容体/β-カテニンのシグナル伝達系に作用してβ-カテニンの働きを抑制することによってc-MycやサイクリンD1の発現を抑制する作用も指摘しています。
ビタミンD3とメトホルミンの併用は、相乗効果によって発がん抑制や抗腫瘍効果を高めることができるという結論です。
ケトン食もAMPKを活性化し、Akt/mTORシグナル伝達系を抑制します。したがって、ケトン食を実践しているとき、ビタミンD3とメトホルミンを併用すると、抗腫瘍効果を高めることができます。
進行した乳がんの代替医療として、高用量(1日4000~10000国際単位)のビタミンD3とメトホルミン(1日1000~1500mg程度)とケトン食の組合せは、相乗効果が期待できると考えられます。ビタミンD3もメトホルミンも安価ですので、試してみる価値は高いと言えます。
この組合せは乳がんだけでなく、大腸がんや膵臓がんや肺がんなど他のがんにも効果が期待できます。
原文:
Vitamin D compounds inhibit cancer
stem-like cells and induce differentiation in triple negative breast cancer.(J
Steroid Biochem Mol Biol. 2017 Oct;173:122-129. )
Abstract
Triple-negative breast cancer is one
of the least responsive breast cancer subtypes to available targeted therapies
due to the absence of hormonal receptors, aggressive phenotypes, and the
high rate of relapse.
Early breast cancer prevention may therefore play an important role in
delaying the progression of triple-negative breast cancer.
Cancer stem cells are a subset of cancer cells that are thought to be
responsible for tumor progression, treatment resistance, and metastasis.
We have previously shown that vitamin D compounds, including a Gemini
vitamin D analog BXL0124, suppress progression of ductal carcinoma in situ
in vivo and inhibit cancer stem-like cells in MCF10DCIS mammosphere cultures.
In the present study, the effects of vitamin D compounds in regulating
breast cancer stem-like cells and differentiation in triple-negative breast
cancer were assessed.
Mammosphere cultures, which enriches for breast cancer cells with stem-like
properties, were used to assess the effects of 1α,25(OH)2D3 and
BXL0124 on cancer stem cell markers in the triple-negative breast cancer cell
line, SUM159.
Vitamin D compounds significantly reduced the mammosphere forming
efficiency in primary, secondary and tertiary passages of mammospheres
compared to control groups.
Key markers of cancer stem-like phenotype and pluripotency were analyzed
in mammospheres treated with 1α,25(OH)2D3 and BXL0124.
As a result, OCT4, CD44 and LAMA5 levels were decreased.
The vitamin D compounds also down-regulated the Notch signaling molecules,
Notch1, Notch2, Notch3, JAG1, JAG2, HES1 and NFκB, which are involved in
breast cancer stem cell maintenance.
In addition, the vitamin D compounds up-regulated myoepithelial differentiating
markers, cytokeratin 14 and smooth muscle actin, and down-regulated the luminal
marker, cytokeratin 18. Cytokeratin 5, a biomarker associated with
basal-like breast cancer, was found to be significantly down-regulated by the
vitamin D compounds.
These results suggest that vitamin D compounds may serve as potential
preventive agents to inhibit triple negative breast cancer by regulating
cancer stem cells and differentiation.
ジクロロ酢酸はパクリタキセル耐性の肺がん細胞をパクリタキセル感受性に変換する
ジクロロ酢酸はパクリタキセル耐性の肺がん細胞をパクリタキセル感受性に変換する
Suppression of pyruvate dehydrogenase kinase-2 re-sensitizes
paclitaxel-resistant human lung cancer cells to paclitaxel.(ピルビン酸脱水素酵素キナーゼ-2の抑制は、パクリタキセル耐性ヒト肺がん細胞をパクリタキセル感受性にする)Oncotarget. 2017 Apr
10;8(32):52642-52650.
【要旨】
治療開始後の初期の臨床的効果は顕著であっても、パクリタキセルで治療された大部分の肺がん患者は、最終的にはパクリタキセルに耐性になる。ピルビン酸脱水素酵素キナーゼ-2(PDK2)は、解糖および酸化的リン酸化の重要な調節因子であり、その発現は様々な腫瘍において増加する。本研究では、生化学および同位体追跡法を用いて、肺がん細胞におけるパクリタキセル耐性の機序におけるPDK2の役割を調べた。
パクリタキセルに感受性の肺がん細胞に比べて、パクリタキセル耐性肺がん細胞ではPDK2の発現亢進が認められた。
siRNAを用いたPDK2遺伝子の発現抑制は、パクリタキセル耐性肺がん細胞のパクリタキセルに対する感受性を増加させた。PDK2発現抑制によるパクリタキセル耐性肺がん細胞への作用は、酸化的リン酸化の亢進よりも解糖の減少として認められた。
PDK2の特異的阻害剤のジクロロ酢酸とパクリタキセルを併用すると、パクリタキセル耐性肺がん細胞の生存率に相乗的な阻害効果を示した。
これらの結果は、パクリタキセルによるPDK2の発現誘導が、肺がん細胞のパクリタキセル耐性の獲得の重要な機序として働くことを示している。これらの結果は、パクリタキセルに耐性を獲得した肺がん患者の治療において、PDK2の阻害が有効である可能性を示している。
ジクロロ酢酸はがん細胞の抗がん剤を高めます。抗がん剤治療中にジクロロ酢酸を服用すると、進行がんでもがんを根治できる可能性が高まります。
ジクロロ酢酸については以下のサイトをご参照下さい。
http://www.1ginzaclinic.com/DCA/DCA.html
http://blog.goo.ne.jp/kfukuda_ginzaclinic/e/550e16665a723f2d6df89f9ba8c94a32
http://www.f-gtc.or.jp/blog/dca.jpg
図:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して(①)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので(②)、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素の活性を高め(③)、R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働き(④)、ピルビン酸脱水素酵素の活性を高めてピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑤)。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増え、乳酸産生が減少し、アポトーシスが起こりやすくなって、抗がん剤感受性が亢進する(⑥)。
原文:
Oncotarget.
2017 Apr 10;8(32):52642-52650.
Suppression of pyruvate dehydrogenase kinase-2 re-sensitizes paclitaxel-resistant human lung cancer cells to paclitaxel.
Abstract
Despite impressive initial clinical responses, the
majority of lung cancer patients treated with paclitaxel eventually develop
resistance to the drug. Pyruvate dehydrogenase kinase-2 (PDK2) is a key
regulator of glycolysis and oxidative phosphorylation, and its expression is
increased in a variety of tumors. In this study, the role of PDK2 in mediating
paclitaxel resistance in lung cancer cells was investigated using biochemical
and isotopic tracing methods. Increased expression of PDK2 was observed in
paclitaxel-resistant cells ascompared totheir parental cells. Down-regulation
of PDK2 usingsiRNA increased the sensitivity to paclitaxel of resistant lung
cancer cells. Targeting paclitaxel-resistant cells throughPDK2 knockdown was
associated with reduced glycolysis rather than increased oxidative
phosphorylation (OXPHOS). Moreover, combining paclitaxel withthe specific PDK2
inhibitor dichloroacetate had a synergistic inhibitory effect on the viability
of paclitaxel-resistant lung cancer cells. These results indicate that
paclitaxel-induced expression of PDK2 serves as an important mechanism for
acquired paclitaxel resistance of lung cancer cells. They also highlight the
importance of PDK2 for potential therapeutic interventions in patients who have
developed a resistance to paclitaxel.
ジクロロ酢酸とメトホルミンはがん細胞の増殖を相乗的に抑制する
ジクロロ酢酸とメトホルミンはがん細胞の増殖を相乗的に抑制する
Dichloroacetate and metformin synergistically suppress the growth of ovarian cancer cells.(ジクロロ酢酸とメトホルミンは卵巣がん細胞の増殖を相乗的に抑制する)Oncotarget. 2016 Sep 13;7(37):59458-59470.
【要旨】
ジクロロ酢酸とメトホルミンはいずれも、がん細胞の代謝を制御することによって有望な抗腫瘍効果を示している。しかしながら、ジクロロ酢酸は細胞保護的なオートファジーを誘導し、メトホルミンは乳酸蓄積を引き起こす作用によって、その抗がん作用の可能性を制限している。
したがって、それぞれの欠点を克服することによって、それぞれの治療効果を高めることができる。
本研究では、ジクロロ酢酸とメトホルミンが、卵巣がん細胞の増殖抑制とアポトーシス誘導において相乗的に効果を増強することを明らかにした。
興味深いことに、ジクロロ酢酸によって誘導されるMcl-1タンパクと細胞保護的オートファジーをメトホルミンは劇的に減弱し、メトホルミンによって引き起こされる過剰な乳酸蓄積とグルコース消費をジクロロ酢酸が著しく減弱した。
ヌードマウスを使った移植腫瘍の実験では、ジクロロ酢酸とメトホルミンは異種移植卵巣腫瘍の増殖を相乗的に抑制した。これらの結果は、ジクロロ酢酸とメトホルミンの併用は、卵巣がんの治療のための新しい戦略を開発する道を開くかもしれない。
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。糖尿病だけでなくがんの予防や治療の分野でも注目されており、がんの発生を予防する効果やがん細胞の抗がん剤感受性を高める効果が報告されています。
メトホルミンはミトコンドリアの呼吸酵素複合体1(電子伝達複合体1)を阻害してATPの産生を減らし、そのためにAMP:ATP比が上昇するためにAMPKが活性化されます。つまり、メトホルミンはミトコンドリア毒であり、この毒を適量使うと血糖を低下させることができるというメカニズムです。
さて、その作用機序から、ミトコンドリアの呼吸酵素複合体をメトホルミンで阻害した状態でジクロロ酢酸でがん細胞のミトコンドリアの代謝を亢進すれば、がん細胞に比較的特異的に酸化ストレスを高めることができます。
上記のようなジクロロ酢酸とメトホルミンの相乗的な抗腫瘍効果については複数の論文報告があります。
体内で産生された乳酸は肝臓で糖新生に使われます。これをコリ回路と言います。メトホルミンは肝臓における糖新生を阻害するので、体内で乳酸蓄積を引き起こして乳酸アシドーシスの副作用が起こすリスクがあります。
がん組織では乳酸産生が亢進していますが、メトホルミンだけでは乳酸アシドーシスを引き起こすリスクを高めます。
ジクロロ酢酸は乳酸アシドーシスの治療に使われています。ミトコンドリアでの代謝を活性化して乳酸産生を抑えるためです。
したがって、がん治療の目的でメトホルミンを使用するとき、ジクロロ酢酸の併用は、抗腫瘍効果増強と副作用軽減の目的で、合理的な組合せと言えます。
原文:
Oncotarget.
2016 Sep 13; 7(37): 59458-59470.
Dichloroacetate and metformin
synergistically suppress the growth of ovarian cancer cells
Abstract
Both dichloroacetate (DCA) and metformin (Met) have shown promising
antitumor efficacy by regulating cancer cell metabolism. However, the
DCA-mediated protective autophagy and Met-induced lactate accumulation limit
their tumor-killing potential respectively. So overcoming the corresponding
shortages will improve their therapeutic effects. In the present study, we
found that DCA and Met synergistically inhibited the growth and enhanced the
apoptosis of ovarian cancer cells. Interestingly, we for the first time revealed
that Met sensitized DCA via dramatically attenuating DCA-induced Mcl-1 protein
and protective autophagy, while DCA sensitized Met through markedly alleviating
Met-induced excessive lactate accumulation and glucose consumption. The in
vivo experiments in nude mice also showed that DCA and Met synergistically
suppressed the growth of xenograft ovarian tumors. These results may pave a way
for developing novel strategies for the treatment of ovarian cancer based on
the combined use of DCA and Met.
カンナビジオールはトリプル・ネガティブ乳がんの増殖・転移を抑制する
カンナビジオールはトリプル・ネガティブ乳がんの増殖・転移を抑制する
Modulation of the tumor microenvironment and
inhibition of EGF/EGFR pathway: Novel anti‐tumor
mechanisms of Cannabidiol in breast cancer(腫瘍の微小環境の制御とEGF/EGFR経路の阻害:乳がんに対するカンナビジオールの新規の抗腫瘍効果のメカニズム)Mol Oncol. 2015 Apr; 9(4): 906-919.
【要旨】
精神作用のないカンナビノイドの一種であるカンナビジオールの抗腫瘍効果に関しては十分に検討されておらず、特にトリプルネガティブ乳がんに対する作用についてはほとんど検討されていない。
この研究では、トリプルネガティブ乳がん細胞を含めて高度に悪性度の高い乳がん細胞株を用いて、カンナビジオールの抗腫瘍活性を検討した。
我々はこの研究で初めて、乳がん細胞における上皮成長因子(EGF)誘導性の増殖と移動をカンナビジオールが有意に阻害することを明らかにした。
カンナビジオールは、EGFRとERKとAKTとNF-κBシグナル伝達系のEGF誘導性の活性化を阻害し、MMP2とMMP9のEGF誘導性の分泌を阻害した。
さらに、マウスを使った複数の実験系で、カンナビジオールは腫瘍の増大と転移を阻害した。
分子メカニズムの解析の結果、カンナビジオールは原発巣と肺転移巣における腫瘍関連マクロファージの集積を有意に阻害した。
培養細胞を使ったin
vitroの実験では、培養がん細胞にカンナビジオールを投与した使用後の培養液はマクロファージ細胞RAW264.7細胞の移動を抑制した。
カンナビジオール投与培養がん細胞の使用後の培養液は、マクロファージの集積と活性化に重要なサイトカインのGM-CSFとCCL3の濃度の低下を認めた。
以上の結果より、カンナビジオールはEGF/EGFRシグナル伝達系の阻害と腫瘍微小環境の制御という新規なメカニズムによって乳がん細胞の増殖と転移を阻害することを初めて明らかにした。
これらの結果は、治療法が限られ、予後が不良なトリプル・ネガティブ乳がんを含めて、悪性度の高い乳がんサブタイプの増殖と転移を阻止する新規の治療法としてカンナビジオールが使用できる可能性を示している。
カンナビジオールの抗がん作用については以下のサイトをご参照下さい。
http://www.f-gtc.or.jp/cannabidiol/CBDoil.html
【原文】
Mol Oncol. 2015 Apr; 9(4): 906-919.
Modulation
of the tumor microenvironment and inhibition of EGF/EGFR pathway: Novel anti‐tumor mechanisms of Cannabidiol in breast cancer
Abstract
The
anti‐tumor role and mechanisms
of Cannabidiol (CBD), a non‐psychotropic
cannabinoid compound, are not well studied especially in triple‐negative breast cancer (TNBC). In the present study, we
analyzed CBD's anti‐tumorigenic activity
against highly aggressive breast cancer cell lines including TNBC subtype. We
show here ‐for the first time‐that CBD significantly inhibits epidermal growth factor
(EGF)‐induced proliferation and
chemotaxis of breast cancer cells. Further studies revealed that CBD inhibits
EGF‐induced activation of EGFR,
ERK, AKT and NF‐kB signaling
pathways as well as MMP2 and MMP9 secretion. In addition, we demonstrated that
CBD inhibits tumor growth and metastasis in different mouse model systems.
Analysis of molecular mechanisms revealed that CBD significantly inhibits the
recruitment of tumor‐associated
macrophages in primary tumor stroma and secondary lung metastases. Similarly,
our in vitro studies showed a significant reduction in the number of
migrated RAW 264.7 cells towards the conditioned medium of CBD‐treated cancer cells. The conditioned medium of CBD‐treated cancer cells also showed lower levels of GM‐CSF and CCL3 cytokines which are important for macrophage
recruitment and activation. In summary, our study shows ‐for the first time‐that CBD inhibits breast cancer growth and metastasis through novel
mechanisms by inhibiting EGF/EGFR signaling and modulating the tumor
microenvironment. These results also indicate that CBD can be used as a novel
therapeutic option to inhibit growth and metastasis of highly aggressive breast
cancer subtypes including TNBC, which currently have limited therapeutic
options and are associated with poor prognosis and low survival rates.
カンナビジオールはドキソルビシン誘発性心筋障害を防ぐ
カンナビジオールはドキソルビシン誘発性心筋障害を防ぐ
Cannabidiol Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial Function and Biogenesis(カンナビジオールはミトコンドリアの機能と新生を制御することによってドキソルビシン誘発性心筋障害を防ぐ)Mol Med. 2015; 21(1): 38-45.
【要旨】
ドキソルビシンは広く使用されている抗腫瘍活性の高い抗がん剤であるが、その用量依存的な心臓毒性によって臨床使用に限界がある。
ドキソルビシンの心臓毒性には活性酸素や一酸化窒素による酸化ストレスの亢進や、心筋細胞や血管内皮細胞のミトコンドリア機能の障害や細胞死が関与している。
カンナビジオールは大麻に含まれる精神活性を持たない成分であり、有害作用は少なく、抗酸化作用や抗炎症作用を有し、さらに最近は抗腫瘍活性も報告されている。ドキソルビシン誘発性の心筋障害のマウスの実験モデルを用いて、カンナビジオールの効果を検討した。
ドキソルビシン誘発性心筋障害は心筋細胞のダメージのレベル(血清中のクレアチニンキナーゼと乳酸脱水素酵素の値)、活性酸素や一酸化窒素による細胞傷害のレベル(細胞内のグルタチオン量、グルタチオンペルオキシダーゼ1活性、脂質過酸化、3-ニトロチロシン形成、誘導性一酸化窒素合成酵素mRNAレベル)、心筋細胞死(アポトーシス、ポリADPリボースポリメラーゼ1依存性)、心筋機能(心拍出機能と左室内径短縮率)で評価した。
ドキソルビシンはミトコンドリア新生を抑制し、ミトコンドリア機能を低下させ(呼吸酵素複合体IとIIの活性低下)、心筋細胞における脱共役たんぱく2と3(uncoupling
protein 2 and 3)とmedium-chain acyl-CoA dehydrogenase mRNAの発現を低下させた。
カンナビジオールの投与は、これらのドキソルビシン誘発性の心筋機能の障害を改善し、活性酸素や一酸化窒素による細胞ストレスと細胞死を軽減した。
カンナビジオールは障害されたミトコンドリア機能とミトコンドリア新生を改善した。
これらの実験結果は、ドキソルビシンによる心筋障害に対する新たな治療法をしてカンナビジオールの有用性を示唆しており、ミトコンドリアの機能や新生に対するカンナビジオールの作用は、他の多くの組織障害の実験モデルでのカンナビジオールの作用機序を説明できるかもしれない。
解説:
カンナビジオールは、活性酸素や一酸化窒素による傷害を軽減する作用、ミトコンドリアの機能や新生を亢進する作用、炎症や細胞死を軽減する作用などのメカニズムで、ドキソルビシン誘発性の心筋傷害や心不全を予防する効果が期待できるという報告です。
この論文では、マウスの実験でカンナビジオールは1日1回、10mg/kgを腹腔内投与しています。人間に換算すれば1〜2mg/kg程度ですが、口腔内からの吸収率を20%くらいに考えると、ヒトでの口腔内(舌下投与)の1日量は5〜10mg/kg程度が基準になると思います。
(動物の標準代謝量は体重の3/4乗(正確には0.751乗)に比例するという法則があり、一般にマウスの体重当たりのエネルギー消費量や薬物の代謝速度は人間の約7倍と言われています。)
他の論文で、カンナビジオールはシスプラチンによる腎臓障害を軽減することが報告されています。さらに、多くのがん細胞に対して抗腫瘍活性を発揮することが報告されています。
カンナビジオールの安全性は極めて高いので、抗がん剤治療の副作用軽減と抗腫瘍効果増強にカンナビジオールの併用は有効だと言えます。
カンナビジオールの詳細は以下のサイトをご参照下さい。
http://www.f-gtc.or.jp/cannabidiol/CBDoil.html
【原文】
Mol Med. 2015 Jan 6;21:38-45. doi:
10.2119/molmed.2014.00261.
Cannabidiol
Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial
Function and Biogenesis.
Hao E1,2, Mukhopadhyay P1, Cao Z1, Erdélyi K1, Holovac E1, Liaudet L3, Lee WS1,4, Haskó G5, Mechoulam R6, Pacher P1.
Abstract
Doxorubicin (DOX) is a widely used, potent chemotherapeutic agent; however, its clinical application is limited because of its dose-dependent cardiotoxicity. DOX's cardiotoxicity involves increased oxidative/nitrative stress, impaired mitochondrial function in cardiomyocytes/endothelial cells and cell death. Cannabidiol (CBD) is a nonpsychotropic constituent of marijuana, which is well tolerated in humans, with antioxidant, antiinflammatory and recently discovered antitumor properties. We aimed to explore the effects of CBD in a well-established mouse model of DOX-induced cardiomyopathy. DOX-induced cardiomyopathy was characterized by increased myocardial injury (elevated serum creatine kinase and lactate dehydrogenase levels), myocardial oxidative and nitrative stress (decreased total glutathione content and glutathione peroxidase 1 activity, increased lipid peroxidation, 3-nitrotyrosine formation and expression of inducible nitric oxide synthase mRNA), myocardial cell death (apoptotic and poly[ADP]-ribose polymerase 1 [PARP]-dependent) and cardiac dysfunction (decline in ejection fraction and left ventricular fractional shortening). DOX also impaired myocardial mitochondrial biogenesis (decreased mitochondrial copy number, mRNA expression of peroxisome proliferator-activated receptor γ coactivator 1-alpha, peroxisome proliferator-activated receptor alpha, estrogen-related receptor alpha), reduced mitochondrial function (attenuated complex I and II activities) and decreased myocardial expression of uncoupling protein 2 and 3 and medium-chain acyl-CoA dehydrogenase mRNA. Treatment with CBD markedly improved DOX-induced cardiac dysfunction, oxidative/nitrative stress and cell death. CBD also enhanced the DOX-induced impaired cardiac mitochondrial function and biogenesis. These data suggest that CBD may represent a novel cardioprotective strategy against DOX-induced cardiotoxicity, and the above-described effects on mitochondrial function and biogenesis may contribute to its beneficial properties described in numerous other models of tissue injury.