がんの中鎖脂肪ケトン食療法
今あるがんが消えていく『中鎖脂肪ケトン食療法』:ブドウ糖を絶てばがん細胞は死滅する!
ブドウ糖を絶てばがん細胞は死滅する! 今あるがんが消えていく「中鎖脂肪ケトン食」 |
がんに効く食事 がんを悪くする食事 |
||
|---|---|---|---|
 |
がんを消滅させる食事法を解説 福田 一典 著 (銀座東京クリニック) 定価1470円(本体1400円+税) 詳細はこちらへ |
 |
食事ががんに与える影響を徹底解説 福田 一典 著 (銀座東京クリニック) 定価1470円(本体1400円+税) 詳細はこちらへ |
【がん細胞の代謝異常をターゲットにした治療が注目されている】
がん細胞がブドウ糖(グルコース)を多く取り込むことはよく知られています。がん細胞が数を増やしていくには、莫大なエネルギーの産生と、細胞を構成する成分(核酸や細胞膜など)の合成が必要ですが、がん細胞におけるエネルギー産生と物質合成の主な材料がブドウ糖だからです。多くのがん細胞の表面(細胞膜)には、細胞内へのブドウ糖の取り込みを行うブドウ糖輸送体(グルコース・トランスポーター)という蛋白質の量が増えており、正常細胞と比べて数倍〜数十倍ものブドウ糖を取り込んで消費しています。
がんの検査法でPET(Positron Emission Tomography:陽電子放射断層撮影)というのがあります。これはフッ素の同位体で標識したブドウ糖(18F-フルオロデオキシグルコース)を注射して、この薬剤ががん組織に集まるところを画像化することでがんの有無や位置を調べる検査法です。正常細胞に比べてブドウ糖の取り込みが非常に高いがん細胞の特性を利用した検査法です。
このように、がん細胞ではブドウ糖の消費が多いので、がん細胞がブドウ糖を利用できなくすれば、がん細胞の増殖を抑え死滅させることもできます。正常な細胞はブドウ糖が無くても脂肪を燃焼させてエネルギーを産生でき、脂肪と蛋白質とビタミンとミネラルがあれば細胞を増やし、体を正常に維持することができます。糖質(炭水化物)は五大栄養素の一つですが、脂肪(脂質)と蛋白質とビタミンとミネラルは体にとって必須ですが、糖質だけは必須ではありません。エネルギー源として使いやすいので糖質が主食になっていますが、正常細胞は脂肪をエネルギー源として利用できるので、糖質は無くても困らないのです。しかし、がん細胞にとって糖質(ブドウ糖)は必須です。糖質から得られるブドウ糖が利用できなくなれば、がん細胞は増殖も生存もできません。つまり、糖質はがん細胞には必須栄養素ですが、正常細胞には必須では無いと言えます。この違いを利用すると、がん細胞だけを選択的に兵糧攻めにして死滅させることができるのです。
がんは様々な遺伝子変異の蓄積によって生じますが、がん遺伝子やがん抑制遺伝子など細胞のがん化に関連している遺伝子は多数あります。また、細胞の増殖や死を調節するシグナル伝達系は極めて複雑なネットワークを形成しています。しかも、遺伝子変異の種類や異常を起こしているシグナル伝達系は個々のがん組織によって異なり、また同じがん組織であっても遺伝子変異に違いがあるがん細胞が混在しています。つまり、がん組織というのは極めて不均一ながん細胞の集団であることが判っています。
このような多様な遺伝子異常を持つがん細胞に対して、遺伝子変異やシグナル伝達系の異常をターゲットにした治療法に限界があることは明らかです。しかし、がん細胞が増殖するためにはエネルギーを作る燃料と細胞を作る材料が必要であり、この燃料と材料の獲得を阻止すれば、そのがん細胞がどのような遺伝子異常を持っていても関係なく増殖を阻止し死滅させることができます。
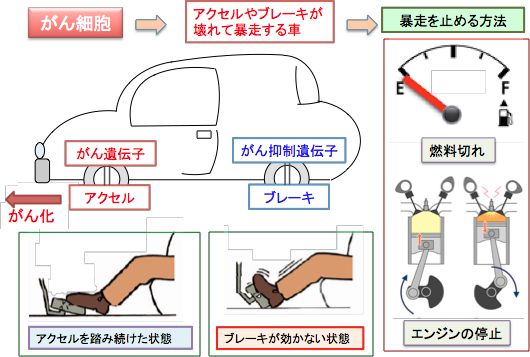
近年、がん細胞における代謝異常(エネルギー産生や物質合成の亢進)ががん治療のターゲットとしても注目されるようになってきています。アクセルとブレーキが故障して猛スピードで暴走している車を止める方法として、アクセルやブレーキを修理したり、あるいは車自体を壊すという方法もありますが、それより燃料を枯渇して補給しないようにすれば、どのような原因で暴走している車でも確実に止めることができるというわけです。
図:がん細胞は車で例えると「アクセルとブレーキが故障して暴走する車」のようなものです。がん遺伝子の活性化は「アクセルを踏み続けた状態」であり、がん抑制遺伝子が働かないのは「ブレーキが壊れた状態」と同じです。このような暴走車を止める手段として、燃料タンクから燃料を抜いたり、エンジンを制御する電位系統を止めるなどの方法があります。がん治療においても、がん細胞の燃料であるブドウ糖を枯渇したり、がん細胞のエネルギー産生系を制御しているシグナル伝達系を阻害すると、がん細胞の暴走(増殖)を止めることができます。
【脂肪が燃焼するとケトン体ができる】
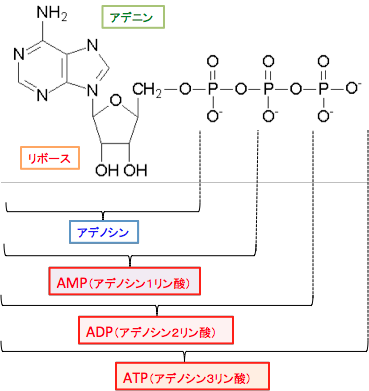
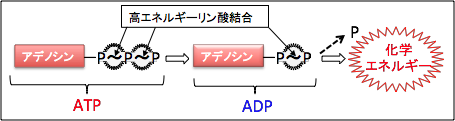
私たちの体を動かすエネルギーは、食物から体内に取り入れた糖質や脂肪や蛋白質を細胞内で分解してATPを作り出すことによって得ています。ATPはアデノシン3リン酸(Adenosine Triphosphate)の略語で、アデノシンに化学エネルギー物質のリン酸が3個結合したものです。リン酸を切り離すときにエネルギーが生じ、細胞内でエネルギーの貯蔵と供給を行うエネルギー通貨のような分子です。細胞は糖質や脂肪に保存されている化学エネルギーをATP分子に捕獲し、筋肉の収縮や物質合成などの細胞の仕事に使っています。
図:ATP(アデノシン3リン酸)は窒素性塩基であるアデニンがリボースに結合し、そのリボースに3つのリン酸基が並んで結合している分子です。ATPから加水分解によってリン酸基が外れるときにエネルギーが放出されます。
細胞は化学的な仕事を行うために必要なエネルギーの獲得と移動に関してATPを使用しており、ATPは生体内のエネルギー通貨として機能しています。
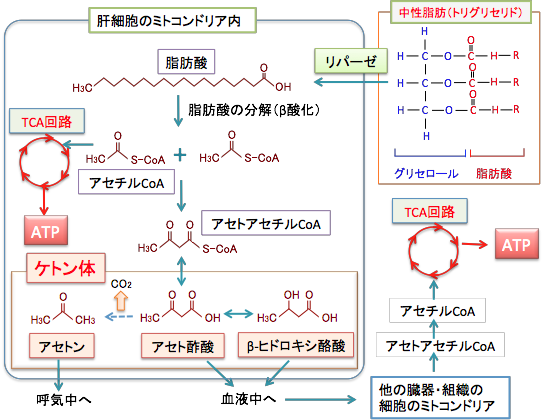
体の中で最初に使われる貯蔵エネルギー源は筋肉細胞と肝細胞に貯蔵されているグリコーゲンです。グリコーゲンはブドウ糖が多数結合したもので、通常、体内には100〜300グラム程度しか貯蔵されていません。したがって、絶食をすると貯蔵されていたグリコーゲンは数時間から半日程度で枯渇します。グリコーゲンが枯渇すると、細胞は脂肪を燃焼させてATPを産生するようになります。体内の脂肪は脂肪分解酵素のリパーゼの働きでグリセロール(グリセリンとも言う)と脂肪酸に分解され、グリセロールはブドウ糖に変換されてエネルギー源になり、脂肪酸は細胞のミトコンドリアという小器官でさらに分解されてATP産生に使われます。
ブドウ糖が枯渇した状態で脂肪酸が燃焼するとき肝臓ではケトン体(アセト酢酸とβ-ヒドロキシ酪酸)という物質ができます。このケトン体は脳にエネルギー源を供給するために肝臓で作られる物質です。通常、脳はブドウ糖しかエネルギー源として利用できません。脂肪酸は血液脳関門を通過できないので、脳は脂肪酸をエネルギー源として利用できないのです。体はブドウ糖が枯渇したときに脳のためにエネルギー源を作らなければなりません。そこで、肝臓では脂肪酸を分解する過程でケトン体を生成するように進化したのです。ケトン体は水溶性で細胞膜や血液脳関門を容易に通過し、骨格筋や心臓や腎臓や脳など多くの臓器に運ばれ、これらの細胞のミトコンドリアで代謝されてブドウ糖に代わるエネルギー源として利用されます。特に脳にとってはブドウ糖が枯渇したときの唯一のエネルギー源となります。
図:中性脂肪(トリグリセリド)は脂肪分解酵素(リパーゼ)の働きでグリセロールと脂肪酸に分解され、脂肪酸は細胞のミトコンドリア内でβ酸化を受けてアセチルCoAが産生され、このアセチルCoAがTCA回路(クエン酸回路)で代謝されてエネルギー(ATP)を産生します。飢餓状態などブドウ糖(グルコース)が枯渇した状態では、脂肪酸の分解が亢進し、肝細胞のミトコンドリアでは、過剰に産生されたアセチルCoAの一部はアセトアセチルCoAを経てアセト酢酸、βヒドロキシ酪酸、アセトンに変換されます。この3つをケトン体と言います。アセト酢酸とβヒドロキシ酪酸は肝細胞から血液に入って他の臓器・組織の細胞に運ばれ、再びアセチルCoAに変換されてTCA回路でATP産生に使われます。ケトン体はグルコースが枯渇したときの代替エネルギー源として、絶食時などで日常的に産生されています。正常細胞(肝細胞と赤血球以外)はエネルギー源としてケトン体を利用できますが、がん細胞はケトン体をエネルギーに変える酵素が欠損しているので、グルコースを減少させ、ケトン体を増やすと、がん細胞だけを兵糧攻めにできます。
【ケトン体を増やせばがん細胞は死滅する】
ケトン体というのはブドウ糖が枯渇したときに脂肪が分解してできる生理的燃料です。肝細胞と赤血球以外の正常細胞はケトン体をエネルギー源として利用できます。肝細胞は他の組織のためにケトン体を産生する工場であり、作ったケトン体を自分で消費しないように、ケトン体をエネルギーに変換する酵素が欠損しているのです。赤血球はミトコンドリアが無いためケトン体を代謝できません。その他の正常細胞はケトン体を代謝してATPに変換できます。
がん細胞ではケトン体をエネルギーに変換する酵素系の活性が低下しているので、ケトン体をエネルギー源として利用できません。また、がん細胞では細胞を増やすために脂肪酸を合成する酵素系の活性が非常に高くなっていますが、逆の脂肪酸を分解してエネルギーを産生する酵素の活性は低下しています。
つまり、体内のブドウ糖の量を減らし、脂肪酸の分解でATPを得ている体内状況を作り出せば、ミトコンドリアの機能が正常な正常細胞は脂肪酸の代謝によってATPを効率的に産生できるので生存できるのに対し、がん細胞は脂肪酸からATPを産生できないためエネルギーが枯渇して死滅するのです。
さらに、ケトン体のアセト酢酸とβヒドロキシ酪酸にはそれ自体に抗がん作用があります。がん細胞と正常線維芽細胞の培養細胞を使った実験で、培養液にアセト酢酸やβヒドロキシ酪酸を添加すると、正常な線維芽細胞の増殖は阻害されず、がん細胞の増殖は用量依存的に抑制されることが報告されています。ケトン体ががん細胞のブドウ糖の取り込みと代謝を阻害するためだと考えられています。また、がん細胞を移植した動物実験でも、ケトン体を多く出させる中鎖脂肪酸の豊富な高脂肪食を与えると、腫瘍の成長が抑えられ、がんによる体重の減少を防ぐ事が報告されています。進行がんにおいては、糖質の多い食事より、糖質を少なくして脂肪や蛋白質を増やした食事の方が症状の改善やがんの進行抑制に効果があることが報告されています。
【インスリンの分泌を減らせばがん細胞の増殖は止まる】
糖質の摂取を減らすだけで、がん細胞の増殖を抑えることができます。その理由は高血糖(血中のブドウ糖濃度が高い状態)とインスリンがともにがん細胞の増殖を刺激する作用があるからです。したがって、血糖とインスリン分泌が減れば、がん細胞の増殖刺激が低下することになります。
がん細胞はブドウ糖をエネルギー源として大量に取り込んでいるため、高血糖はがん細胞の増殖に有利になります。がん細胞はブドウ糖をエサに増殖しているのです。高血糖は活性酸素の産生を高め、血管内皮細胞や基底膜にダメージを与えて血管透過性を高め、転移を起こしやくするという意見もあります。高血糖はマクロファージを活性化して炎症性サイトカイン(TNF-αやIL-6など)の産生を刺激します。炎症性サイトカインはがん細胞の増殖や浸潤や転移を促進します。
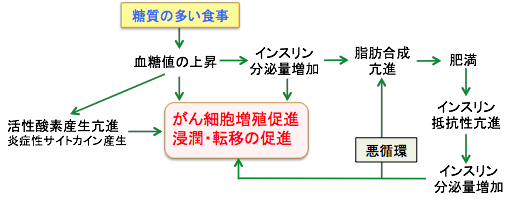
食事で糖質を摂取すると血糖値が上がります。血糖値が上がると体は膵臓からインスリンというホルモンを分泌して血糖を下げようとします。インスリンはブドウ糖の筋肉組織や脂肪組織への取り込みを亢進してブドウ糖の分解を促進します。さらに、肝臓ではグリコ−ゲンの合成を促進し、脂肪組織では脂肪の合成が促進されます。このようにインスリンはブドウ糖の分解とグリコーゲンや脂肪の合成の両方を高めることによって血糖を下げます。
インスリンは食後の血糖値を下げるのが主な作用ですが、がん細胞の増殖を促進する作用もあります。がん細胞の表面(細胞膜)にあるインスリン受容体にインスリンが結合すると、細胞増殖のシグナルが活性化し、がんの発育や転移が促進されます。
図:糖質の多い食事は血糖値を上げ、上昇した血糖値を下げるためにインスリンの分泌量も多くなります。インスリンはそれ自体にがん細胞の増殖や浸潤・転移を促進する作用があります。インスリンは脂肪の合成や蓄積を促進して肥満を引き起こし、肥満はインスリン抵抗性を高めるため、さらにインスリンの分泌が増えて悪循環を形成します。したがって、糖質を減らすことはがん細胞の発生や増殖や進展を抑える効果があります。 さらに、インスリンはがん細胞の増殖を促進するインスリン様成長因子-1(IGF- 1)の活性を高めます。高インスリン血症は、IGF-1の活性を制御しているIGF-1結合蛋白の肝臓での産生量を減少させ、その結果、IGF-1の活性が高まるからです。 体の成長を促進する成長ホルモンは肝臓に働きかけてインスリン様成長因子-1(IGF-1)を分泌させ、このIGF-1が標的組織の細胞分裂を刺激します。したがって、多くの臓器や組織の細胞にIGF-1の受容体があり、それらの細胞から発生するがん細胞の多くがIGF-1受容体を持っています。IGF-1は70個のアミノ酸からなり、インスリンと似た構造をしています。IGF-1受容体とインスリン受容体も類似しており、IGF-1とインスリンが交差反応することが知られています。インスリンとIGF-1はそれぞれの受容体に結合して細胞を刺激すると、細胞増殖と代謝を促進するシグナル伝達経路を活性化して、栄養素の取り込みやエネルギー産生を高め、細胞増殖や血管新生や転移を促進し、抗がん剤抵抗性を高めます。
糖質の多い食事で血糖が上がるとインスリンの分泌が増え、さらにインスリン様成長因子-1の産生と活性も高まることになります。糖質を摂取しなければ、血糖もインスリンの分泌もインスリン様成長因子-1の産生も増えないので、がん細胞の増殖を刺激することもなくなります。
培養したがん細胞を使った実験で、培養液のブドウ糖濃度を高めるとがん細胞の増殖や転移や浸潤が促進されます。高濃度のブドウ糖がある状態でインスリンを添加すると、増殖シグナル伝達系の刺激により、増殖や浸潤能はさらに促進されます。生体でも同様で、食事のたびに血糖やインスリンが上昇するとその都度がん細胞の増殖が刺激されることになるのです。したがって、糖質の摂取を減らして、血糖とインスリンが上昇しないようにすれば、それだけでがん細胞の増殖を抑える効果が期待できるのです。
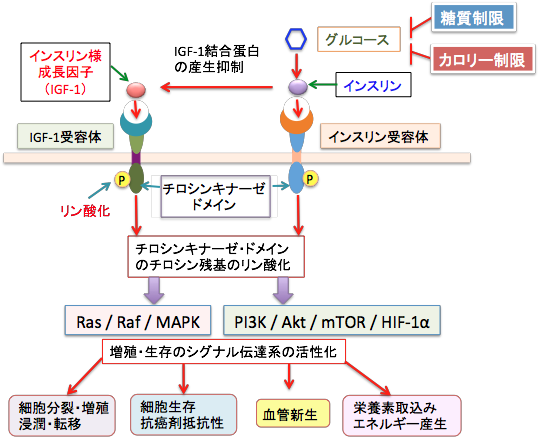
図:グルコース(ブドウ糖)とインスリンは直接的にがん細胞の増殖を促進する作用を持ちます。さらに、高インスリン血症はインスリン様成長因子(IGF-1)を介して増殖や転移や抗がん剤抵抗性を促進します。インスリンおよびインスリン様成長因子はそれらの受容体に結合することによって受容体のチロシンキナーゼ・ドメインをリン酸化し、増殖と生存に重要な役割を果たす細胞内シグナル伝達系のRas / Raf / MAPK経路とPI3K / AKT / mTOR経路を活性化します。カロリー制限や糖質制限は、これらの経路を阻止することによって抗がん作用を発揮します。
【糖質を制限すれば高脂肪食でもがんを促進しない】
がんの発生や再発の予防を目的とした食事療法では、脂肪を減らすことが推奨されています。全カロリーの45〜65%を糖質から摂取し、脂肪からのカロリーは食事全体のカロリーの20〜30%程度が望ましいと言うのが一般的な意見です。 しかし、脂肪の取り過ぎが危険なのは糖質を主食にする場合です。食事からの摂取カロリーの半分以上を糖質から摂取する食事内容では、脂肪の摂り過ぎは発がんリスクを高めます。しかし、糖質を制限した場合には高脂肪食は発がんリスクを高めることありません。その第一の理由は、脂肪を摂取しても血糖もインスリンの分泌も増えないからです。
また、がんや動脈硬化の原因になるとなるのは、動物性の飽和脂肪酸やω6不飽和脂肪酸の多い一部の植物油を多く摂取した場合です。逆に、オレイン酸を含むオリーブオイルやω3不飽和脂肪酸のエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)を含む魚油、αリノレン酸を含む亜麻仁油(フラックスシードオイル)や紫蘇油(エゴマ油)を多く摂取するとがんも動脈硬化性疾患も減らせることが明らかになっています。
つまり、糖質の摂取を減らすことと、がん予防に有効な脂肪を主体にすれば、脂肪の摂取量を増やしても、がん細胞の増殖を促進することは無いのです。
【絶食と同じ効果があるケトン食療法】
がん細胞にブドウ糖を与えないという目的であれば、断食療法やカロリー制限は効果がありますが、断食療法は体重が減少し栄養素が不足する欠点があり、カロリー制限も体重や体力を低下させる欠点があります。抗がん剤などで治療を行っているときには、断食やカロリー制限は実施しにくいと言わざるを得ません。
絶食と同じような効果があって体力も栄養状態も悪化させない食事療法として「ケトン食」があります。これは糖類の摂取を極端に減らし、脂肪を多く摂取しケトン体を産生させるという食事で、てんかんの食事療法として確立されている食事法です。
ケトン体はブドウ糖が枯渇したときに肝臓で脂肪酸の分解が亢進したときにできる物質です。正常細胞では、ケトン体を使ってエネルギー(ATP)を産生することができるのですが、多くのがん細胞はケトン体を利用できません。ケトン体からATPを産生するときに必要な酵素の活性が低下しているからです。そこで、がん細胞が利用できるブドウ糖の量を減らし、がん細胞が利用できないケトン体を増やしてがん細胞だけを死滅させる食事療法としてケトン食が注目されています。 食事の糖質を制限して血糖とインスリンの分泌を低下させれば、がん細胞の増殖を抑えることができます。ケトン体を増やせば、さらに抗がん作用が強化されるという理論です。がん細胞だけを兵糧攻めにできる食事療法と言えます。
【中鎖脂肪酸はケトン体の産生効率を高める】
脂肪はグリセロール(グリセリンともいう)1分子に3分子の脂肪酸が結合した構造をしています。食事から摂取した脂肪は、十二指腸で胆汁と混じって乳化され、胃液や膵液のリパーゼによってグリセロールと脂肪酸に分解されて吸収されます。グリセロールは肝臓でブドウ糖に変換されてエネルギー源になります。脂肪酸は複数個の炭化水素(CH2)が連結した鎖からなり、炭素数が7以下のものを短鎖脂肪酸、8〜12のものを中鎖脂肪酸、13以上のものを長鎖脂肪酸といいます。
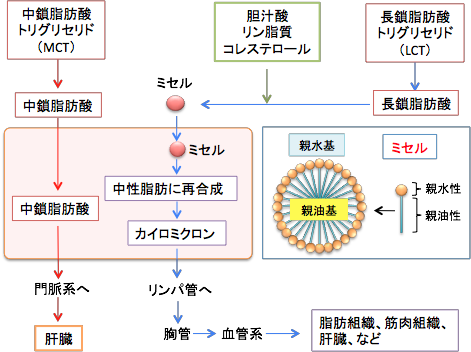
長鎖脂肪酸は腸壁を通り抜けると、腸管粘膜上皮細胞内で再びグリセロールと結合して中性脂肪(トリグリセリド)になり蛋白質などと一緒になってカイロミクロンというリポ蛋白質粒子になります。カイロミクロンとなった脂肪酸はリンパ管や血管を経て脂肪組織や筋肉組織に運ばれて一旦貯蔵され、グリコーゲンが枯渇したときに分解されて、ゆっくりと消費されます。つまり、長鎖脂肪酸はエネルギーとして代謝されにくく、体脂肪として蓄積されやすい脂肪酸です。
一方、中鎖脂肪酸は分子が小さいため消化管から効率的に吸収され、カイロミクロンを作らずに門脈に入って肝臓に運ばれ、肝細胞のミトコンドリアで素早く酸化され、大量のATPとケトン体を生じる特徴があります。中鎖脂肪酸はエネルギーとして燃焼される効率が高く、体脂肪として蓄積しにくいので、最近では中鎖脂肪酸を含む脂肪(中鎖脂肪酸トリグリセリドあるいは中鎖中性脂肪)はダイエットや健康によい油として急速に普及しています。手術後や未熟児の栄養補給に医療現場でも利用されている健康的な脂肪です。
長鎖脂肪酸は糖類が存在するとケトン体産生が抑えられますが、中鎖脂肪酸からケトン体を作る経路は糖質の影響をほとんど受けずにケトン体が多量に産生されます。肝臓ですぐに分解される中鎖脂肪酸を利用すると、脂肪の割合を60%程度に減らし、糖質を1日40〜60g程度摂取しても、ケトン体を大量に産生することができます。
日本で使われている食用油(菜種油、大豆油、紅花油、ごま油、オリーブ油、ひまわり油、コーン油など)は長鎖脂肪酸(炭素数が13以上)が主成分です。一方、中鎖脂肪酸(炭素数が8〜12)を多く含む油としてはヤシ油(ココナッツオイル)があります。ココナッツオイルには、60〜70%の中鎖脂肪酸トリグリセリド(中鎖脂肪)が含まれていますが、ケトン食療法用の中鎖脂肪酸トリグリセリド100%のオイル(キッセイ薬品のマクトンオイルや日清オイリオ社のMCTオイル)も市販されています。中鎖脂肪酸が長鎖脂肪酸よりもケトン体を多く産生でき、炭水化物や蛋白質の許容量が高いので、より調理がしやすく食べやすいケトン食を作れます。このように、中鎖脂肪をうまく利用するのが、がん治療に対する中鎖脂肪ケトン食療法のポイントになります。古典的なケトン食は脂肪:非脂肪(糖質+蛋白質)を4:1くらいにしていますが、中鎖脂肪酸を多めに使うとこの比率を2以下まで減らせます。
脂肪はグリセロール(グリセリンともいう)1分子に3分子の脂肪酸が結合した構造をしており、これを中性脂肪(トリグリセリド)と言います。食事から摂取した脂肪は十二指腸や小腸内で膵液中のリパーゼによって加水分解され、トリグリセリド(中性脂肪)から脂肪酸とグリセロールが分離されます。グリセロールは水溶性なのでそのまま小腸から毛細血管に吸収され、解糖系で代謝されたり、糖新生によってブドウ糖に変換されます。
脂肪酸は水に不溶性ですが、胆嚢から十二指腸に分泌される胆汁中に含まれる胆汁酸やホスファチジルコリンやコレステロールによって乳化されたミセルを形成します。ミセルというのは、水になじむ部分(親水基)と油になじむ部分(親油基)をもつ物質が、水の中で親水基を外に親油基を内に向けて球状に会合した粒子です。ミセルは水溶性で受動拡散によって消化管粘膜の吸収上皮細胞内に吸収されます。
脂肪酸が腸管から吸収されるとき、脂肪酸の大きさ(炭素鎖の長さ)の違いによって代謝のされかたが異なります。炭素数が13以上の長鎖脂肪酸の場合は、腸壁を通り抜けると、腸管粘膜上皮細胞内で再びグリセロールと結合して中性脂肪(トリグリセリド)になり蛋白質などと一緒になってカイロミクロンというリポ蛋白質粒子になります。カイロミクロンはリンパ管から胸管に入り、鎖骨下静脈から大循環系に入って全身に運ばれます。主に脂肪組織や筋肉組織に取込まれ、一旦貯蔵されてからグリコーゲンが枯渇したときに分解されて、ゆっくりと消費されます。つまり、長鎖脂肪酸はエネルギーとして代謝されにくく、体脂肪として蓄積されやすい脂肪酸です。
炭素数が8~12の中鎖脂肪酸は胆汁酸によるミセル化は不要で、小腸吸収細胞に容易に吸収され、分子が小さいことから腸管で毛細血管に吸収され、長鎖脂肪酸のように中性脂肪に再合成されず、カイロミクロンを作らずに遊離脂肪酸のまま門脈に入って肝臓へ運ばれ、速やかにエネルギー源となって代謝されます。中鎖脂肪酸は肝細胞内のミトコンドリアに入り、炭素分子が1つおきに酸化されるβ酸化という過程に入ってアセチルCoA を生じてTCA 回路に入って代謝されますが、ブドウ糖の補給が少ない状況ではアセチルCoAはケトン体産生に利用されます。
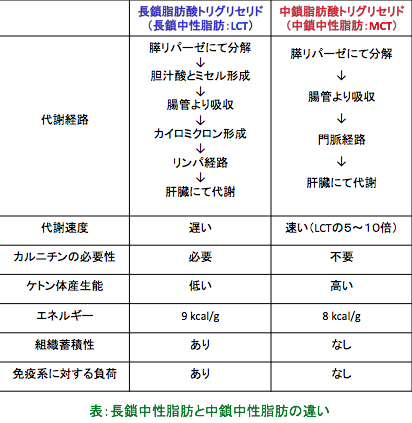
脂肪酸がβ酸化のためにミトコンドリアに取込まれるとき、長鎖脂肪酸はL-カルニチンが必要ですが、中鎖脂肪酸はL-カルニチンの助けなしにミトコンドリア内に入って速やかに代謝されます。中鎖脂肪酸はエネルギーとして燃焼される効率が高く、体脂肪として蓄積しにくい脂肪酸です。
中鎖脂肪酸は長鎖脂肪酸より約4倍も吸収が速く、代謝も5〜10 倍も速いと言われています。このように中鎖脂肪酸のエネルギー利用速度は速いので、激しい運動の持続時間を延長する効果も報告されています。また、長鎖脂肪酸は感染防御や免疫系に負荷がかかりますが中鎖脂肪は影響が少なく、また組織への蓄積傾向や臓器障害のもととなる脂質過酸化反応も少ないためより安全に摂取できます。
長鎖脂肪酸は糖類が存在するとケトン体産生が抑えられますが、中鎖脂肪酸からケトン体を作る経路は糖質の影響をほとんど受けずにケトン体が多量に産生されます。肝臓ですぐに分解される中鎖脂肪酸を利用するとケトン体を大量に産生することができます。
【ケトン食は安全な食事療法】
「ケトン食」というのは、体内でケトン体が多く産生されるように考案された食事です。古来、さまざまな疾患に絶食療法が行われており、特にてんかん発作が絶食によって減少することは古くから知られていました。そして、「脂肪を多く炭水化物の少ない食事をと摂れば、絶食と同等の効果が得られる」という考えのもとに、1920年代に米国のメイヨークリニックでケトン食療法(ketogenic diet)が発案されました。
1960年代には、中鎖脂肪酸を使うとケトン体の産生効率が高いことが明らかになり、中鎖脂肪酸を利用したケトン食が利用されています。このようにケトン食自体は非常に歴史の古い食事療法です。ケトン食は難治性てんかんの治療以外に、ブドウ糖を細胞内に取り込めないグルコース・トランスポーター1型欠損症に極めて有効で唯一の治療法としても利用されています。さらに、ケトン体は脳神経のエネルギー代謝を改善し、活性酸素や炎症から神経細胞を保護する作用があるので、ケトン食療法はアルツハイマー病やパーキンソン病や脳卒中等を原因とする脳神経細胞障害の進行抑制にも利用されています。
ケトーシス(ケトン症:ketosis)は血中のケトン体が増加した状態です。ケトン体のアセト酢酸とβ-ヒドロキシ酪酸は酸性が強いので、ケトン体が血中に多くなると血液や体液のpHが酸性になります。このようにケトン体が増えて血液や体液が酸性になった状態をケトアシドーシス(ketoacidosis)と言います。
糖尿病性ケトアシドーシスは主に1型糖尿病患者に起こり、インスリンが不足した状態で脂肪の代謝が亢進し、血中にケトン体が蓄積してアシドーシス(酸性血症)を来たし、ひどくなると意識障害を引き起こし、治療しなければ死に至ります。このように糖尿病の人では血液中のケトン体濃度の上昇は糖尿病の悪化を示すサインとして知られていますので、ケトン体は体に悪い物質と思われる方が多いと思います。しかし実際は、インスリンの働きが正常である限りケトン体は極めて安全なエネルギー源なのです。ケトン体を利用する酵素が無い肝細胞とミトコンドリアの無い赤血球を除く全ての細胞でアセチルCoAに変換されて生理的なエネルギー源として利用でき、日常的に産生されているからです。
ケトン体はブドウ糖や脂肪酸より優先的に利用されます。絶食すると数日で血中ケトン体は基準値の30〜40倍もの高値になりますが、インスリンの作用が保たれている限り安全です。一時的に酸性血症(アシドーシス)になることもありますが、血液の緩衝作用によって正常な状態に戻ります。ケトン体の上昇が怖いのは、インスリンの作用不足がある糖尿病の場合で、糖尿病性ケトアシドーシスはインスリン作用の欠乏を前提とした病態です。断食や糖質制限に伴うケトン体産生の亢進の場合は生理的であり、インスリン作用が正常であれば何の問題もありません。
【ケトン食でがんが縮小する臨床報告が増えている】
がんを移植したネズミを使った実験では、ケトン食ががんの増殖速度を遅くし、生存期間を延ばす効果があることが報告されています。この場合、カロリー制限を併用すると抗腫瘍効果が高いのですが、中鎖脂肪酸を多く使いケトン体の産生を増やすケトン食であれば、カロリー制限をしなくても、がん組織の増殖を抑え、生存期間を延ばすことが確認されています。
人間でも、脳腫瘍などの悪性腫瘍の治療におけるケトン食の有効性が報告されています。ケトン食によるがん治療の有効性が最初に報告されたのは1995年のことです。米国のオハイオ州クリーブランドのケース・ウェスタン・リザーブ大学からの報告で、進行した小児がん(脳腫瘍)の患者をケトン食を使って治療し、全身の栄養状態に悪影響を及ぼさずにがん細胞の増殖を抑えることができたという臨床試験の結果を報告しています。この報告では、進行した悪性星細胞腫という脳腫瘍の女児2名を、中鎖脂肪酸トリグリセリド(中鎖脂肪)を60%、他の脂肪10%、蛋白質20%、炭水化物10%というケトン食を使って、8週間外来通院で治療を行っています。ケトン食を開始して7日後には血糖値は正常下限まで低下し、血中ケトン体は20〜30倍に増加しました。PET検査の測定では、ブドウ糖の取り込みは平均21.8%低下しました。患者の一人は、臨床症状の著明な改善と長期間の延命効果が認められています。(J Am Coll Nutr. 14(2):202-8.1995年)
浸潤性の星細胞腫の中でも最も悪性度の高い多形神経膠芽腫(glioblastoma multiforme)は人間のがんの中でもとりわけ予後の悪いがんです。完全に切除できてもほとんどが再発します。手術後に抗がん剤と放射線照射を併用した治療が標準ですが、平均生存期間は数ヶ月です。この治療が困難で予後不良な脳腫瘍の治療(抗がん剤治療+放射線治療)にケトン食療法を併用すると、今までに経験しないような劇的な治療効果が得られたという症例報告があります。手術で完全に切除できなかった65歳女性の多形神経膠芽腫の患者に対して、1日摂取カロリーを600キロカロリーに制限し、ケトン比を4:1(脂肪:蛋白+炭水化物)に設定したケトン食を行い、著明な抗腫瘍効果が認められています。(Nutrition & metabolism. 7:33, 2010年)
脳腫瘍以外のがんでも、ケトン食が抗がん剤治療や放射線治療の効果を高めることが報告されています。人間の胃がんをヌードマウスに移植した実験モデルでは、ω3不飽和脂肪酸と中鎖脂肪酸を使ったケトン食で飼育すると、がんの増殖が遅くなったという報告があります。魚油のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)といったω3不飽和脂肪酸にはがん予防効果やがん細胞の増殖を抑える効果が報告されています。
【ケトン食療法は進行がんに対しても安全で有効】
悪性度の高い大腸がん細胞をマウスに移植して、がん性悪液質を起こす実験モデルでケトン食の効果を検討した研究があります。がんを移植されたマウスは、がんの増殖に応じて、体の脂肪や筋肉の量が減少し体重が減ってきます。このようにがんの増大によって筋肉と脂肪の両方が減少する状態をがん性悪液質と言います。がん組織が出す炎症性サイトカインなどが脂肪や蛋白質の分解(異化)を進行させるのです。この実験モデルにおいて、総カロリーの80%を中鎖脂肪酸から得るようなケトン食を与えると、体重の減少が抑制され、さらに腫瘍自体の成長も抑えられる結果が得られています。ケトン体には、がん細胞の増殖を抑える作用だけでなく、炎症を抑える作用もあり、がん性悪液質の改善にも効果が期待できることを示しています。(Br. J. Cancer, 56: 39-43, 1987年)
末期がんの患者16例を対象に、ケトン食の効果と安全性を検討した報告もあります。この報告では、脂肪と蛋白質が豊富で炭水化物を1日70グラム以下に制限した食事は、臓器の働きを良くし、症状を改善する効果があるという結論が得られています。がん細胞はブドウ糖の利用が高いのですが、筋肉組織など正常組織では脂肪酸や蛋白質の需要が大きいので、糖質を少なくし蛋白質や脂肪の多い食事の方が進行がん患者の状態を良くする効果が高いということです。また、この食事による副作用は認められていません。(Nutr Metab 8(1):54, 2011年)
米国ニューヨーク州のアルバート・アインシュタイン医科大学の放射線科のグループが、ケトン体を増やす糖質制限食の安全性と有効性を検討する目的で10例の進行がん患者を対象に臨床試験を行っています。この研究では、根治治療不可能な進行がん患者でPET検査で腫瘍を検出し、パフォーマンスステータス(performance status:PS)が0〜2で比較的良く、諸臓器機能が正常で糖尿病が無く、最近の体重減少を認めず、BMI(Body Mass Index)が20kg/m2以上の条件を満たす10例を対象に、26〜28日間の糖質制限食を実施しています。その結果、食事療法開始前に腫瘍の早い進行を認めていた9例のうち5例で病状安定(stable disease)あるいは部分奏功(partial remission)をPET検査で確認できました。病状安定とはがんが大きくならなかったことで、部分奏功とは画像検査で長径が30%以上(あるいは面積が50%以上)縮小した場合を言います。効果を認めたこの5例は、進行を続けた4例と比較して、血中のケトン体の量が3倍くらい高かったという結果でした。腫瘍増殖の抑制を認めた5例と進展した4例の間には、カロリー摂取や体重減少の程度には差を認めませんでしたが、ケトン症のレベルは血清インスリンの濃度と逆相関の関係にありました。(Nutrition 28(10): 1028-35, 2012年)
つまり、この臨床試験では、「インスリンの分泌を阻害する食事療法(糖質制限によるケトン食)は進行がん患者において安全に実施できる」「この食事療法による抗腫瘍効果(病状安定および部分奏功)は、摂取カロリーや体重減少の程度とは関係せず、ケトン症の程度(血中ケトン体の濃度)に相関する」という2点が確認されています。
インスリンががん細胞の増殖を促進することは十分な根拠があります。インスリンの分泌を少なくする糖質制限食ががん細胞の増殖を抑制することも多くの動物実験や臨床試験などで証明されています。さらに、ケトン体ががん細胞の増殖を抑制する効果があり、糖質制限と高脂肪食によるケトン食が抗がん作用を示すことも最近多くの研究で明らかになっています。さらにこの報告は、進行がんの治療としてケトン食が十分に効果が期待できることを示しています。この研究で最も重要な結果は、血中のケトン体レベルが高いほど、がん細胞の増殖抑制効果が高いという点です。カロリー摂取や体重減少とは関連せず、ケトン体のみが奏功率と関連するということです。したがって、糖質制限と高脂肪食によるケトン食療法を行うとき、ケトン体を増やす工夫が最も重要だということです。
ケトン体を増やすためには、中鎖脂肪を多く摂取し、長鎖脂肪酸の吸収とβ酸化による分解を促進するために脂肪分解酵素のリパーゼと肝臓での長鎖脂肪酸のミトコンドリアへの運搬を促進するL-カルニチンの摂取は有効です。このような方法を用いて、ケトン体を多く産生させると、食事だけでがんを縮小できるのです。
【がんの中鎖脂肪ケトン食の実践法の概略】
中鎖脂肪ケトン食の基本は、主食の糖質を極力減らすことです。糖質の1日摂取量は40g以下を目標にします。1回の食事につき糖質が20gを超えないようにします。ご飯・パン・麺類・芋類は糖質が豊富なので摂らないようにします。果糖の多い甘い果物も避けます。果糖も体内でグルコースに変換されるからです。糖質を食べるにしても、玄米や全粒粉小麦など精製度の低い炭水化物を少量食べます。
たんぱく質は体重1kg当たり1〜2gを摂取します。体重60kgで60g〜120gです。たんぱく質源としてはがんを促進する赤身の肉(牛肉など)は控え、大豆製食品(豆腐や納豆)や魚や卵や鶏肉などを利用します。豆の中では大豆は糖質含量が少ないので、豆腐や納豆や湯葉など大豆製品は有用です。肉や魚は生の100gで10〜20g程度の蛋白質を含みます。食品中の栄養素の含有量は文部科学省が出している「食品標準成分表」を参考にします。この表はインターネットで検索すれば見つかります。加工した食品には栄養表示があるので、炭水化物や脂肪や蛋白質がどの程度含まれているか確認しておきます。主食を一切省いても、大豆や野菜や魚や肉などにも糖質はある程度含まれています。食品の栄養表示をみながら、糖質の摂取を極力減らし、1日の糖質の摂取量が40グラムを超えないように注意します。総合ビタミン剤などのサプリメントでも糖を入っていないものを選びます。グルコースが十分に供給されていると、脂肪酸の分解でアセチルCoAが増えてもTCA回路で代謝されるので、ケトン体は増えません。
肝臓ですぐに分解される中鎖脂肪酸を利用すると、脂肪の割合を60%程度に減らし、糖質を1日40g程度摂取してもケトン体を大量に産生することができます。中鎖脂肪を多く摂取して、脂肪:糖質+蛋白質の比率を1.5:1、つまり食事の60%を脂肪にするという食事を目標にします。糖質を40g、蛋白質を80g摂取するとカロリーは480キロカロリーになります。糖質+蛋白質の120gの1.5倍の脂肪は180gで、これは1620キロカロリーになります。全てを合わせて2100キロカロリーになります。カロリーは制限する必要はありませんが、過剰に摂取することは意味がありません。必要最小限のカロリー摂取を目標にします。
中鎖脂肪はココナッツオイルや精製した中鎖脂肪(マクトンオイルやMCTオイル)を1日40〜80gを摂取します。がん予防効果があるω3不飽和脂肪酸(DHAやEPA)を多く含む魚の油を多く摂取し、調理にはオリーブオイルを用い、ドレッシングには亜麻仁油や紫蘇油を多めに使います。
食物繊維やビタミン・ミネラルが豊富で糖質の少ないキノコや海草(わかめ、もずく、など)やおからを食材に使用することも有用です。炭水化物には食物繊維と糖質が含まれますが、食物繊維はいくら食べても問題ありません。食物繊維は腸内環境を良くし便秘を防ぎます。
脂肪をグリセロールと脂肪酸に分解する消化酵素のリパーゼの製剤を脂肪の多い食事の後に服用すると、さらに脂肪酸の代謝を促進します。膵消化酵素補充剤のリパクレオンを推奨しています。
中鎖脂肪酸はカルニチンがなくても肝細胞のミトコンドリアに取り込まれますが、長鎖脂肪酸はカルニチンが必要です。サプリメントでカルニチンを摂取することも有用です。
アルコールは糖質の少ないウイスキーや焼酎のような蒸留酒や糖質フリーの発泡酒などであれば糖質制限の観点では問題ありませんが、アルコール自体ががん細胞の増殖を刺激しますので、がん患者さんはアルコールの摂取はできるだけ控えるべきです。
以上のような体内のケトン体産生をわざと増やすような食事療法を行うと、最初の1週間くらいは、脂肪が多いと食後に腹痛がきたり、便秘になったり、倦怠感が出てきます。しかし、食物繊維を多く摂取し消化酵素を利用すると、そのような不快な症状はほとんど経験しなくなります。
【がんの中鎖脂肪ケトン食療法の効果を高める方法】
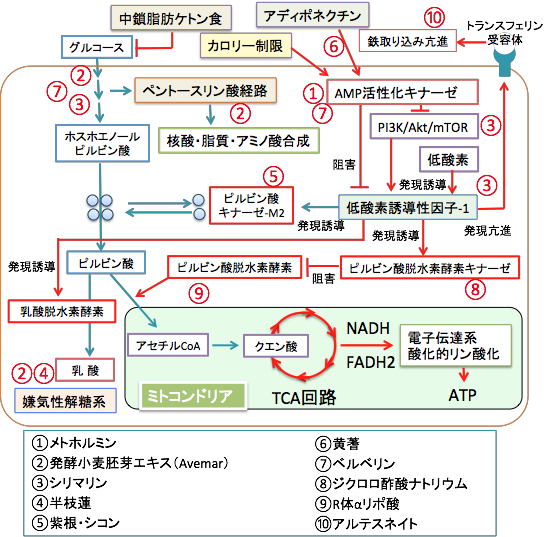
がん細胞のブドウ糖(グルコース)の利用を阻害し、エネルギー産生経路を止めてがん細胞の増殖を抑制し、さらにがん細胞を死滅させる方法として以下のような治療法があります。中鎖脂肪ケトン食療法とこれらの治療法を併用すると抗がん作用を増強できます。
① AMPKを活性化する経口糖尿病治療薬メトホルミン
メトホルミンはAMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)を活性化します。AMPKの活性化はカロリー制限と同じ効果を及ぼし、mTOR(mammalian target of rapamycin)経路を阻害して蛋白質の合成を抑制し、がん細胞の増殖や血管新生を阻害します。さらに、AMPKは嫌気性解糖系を阻害する効果が知られています。
肝臓での糖新生を抑制する作用や腸管からのグルコース吸収を抑制する効果もあります。カロリー制限と同じ効果を発揮するのでケトン食療法にメトホルミンを併用すると抗腫瘍効果を高めることができます。ケトン食とメトホルミンを併用するとがんの縮小効果が高まるという論文が報告されています。(Med Hypotheses. 77(2):171-3, 2011)
さらに、漢方薬に使われる生薬の黄柏(オウバク)や黄連(オウレン)に含まれるベルベリン、冬虫夏草(トウチュウカソウ)に含まれるコルジセピン、多くの植物に含まれるフラボノイドやオレアノール酸にもAMPKを活性化する効果が報告されています。これらを併用すると、カロリー制限と同じ効果が得られ、嫌気性解糖系やがん細胞の増殖の阻害効果を高めることができます。(blog:217話、308話参照)
(メトホルミンの詳細についてはこちらへ)
② ペントース・リン酸経路を阻害するAvemar
Avemar(アヴェマー)は発酵小麦胚芽抽出エキス(Fermented Wheat Germ Extract)を主成分としたサプリメントです。小麦胚芽の抗がん作用の活性成分は、2,6-dimethoxy-p-benzoquinone(2,6-DMBQ)などのメトキシ置換ベンゾキノン類(methoxy-substituted benzoquinones)といわれる物質です。
Avemarの抗腫瘍効果で最も特徴的な点は、がん細胞内のグルコースの代謝を阻害してエネルギー産生を低下させて増殖を抑えることです。 Avewmarはがん細胞のグルコースの取り込みや嫌気性解糖系を阻害することによってがん細胞の増殖を抑制します。さらに、DNAやRNAの合成に必要なペントースリン酸経路の酵素やリボヌクレオチド還元酵素(Ribonucleotide reductase)を阻害する作用が報告されています。 リボヌクレオチド還元酵素は、リボヌクレオチドのリボース部分を還元してデオキシリボースにして、DNA合成の前駆体のデオキシリボヌクレオチドを合成する酵素です。この酵素を阻害するとDNA合成が阻害されてがん細胞の増殖が抑制されます。Avemrには免疫力を高める効果もあります。(詳細はこちらへ)
③グルコースの取り込みと嫌気性解糖系を阻害するシリマリン
低酸素誘導因子-1(Hypoxia Inducible Factor-1; HIF-1)は、細胞が酸素不足に陥った際に誘導されてくる転写因子です。HIF-1は低酸素だけでなく、がん細胞の増殖シグナル伝達系であるPI-3キナーゼ/Akt/mTORシグナル伝達系を介しても活性化されます。したがって、がん細胞では低酸素状態でなくてもHIF-1活性は常時亢進しています。
HIF-1は各種解糖系酵素、グルコース輸送蛋白、血管内皮増殖因子、造血因子エリスロポイエチンなど、多くの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応反応を制御しています。
ミルクシスルに含まれるシリマリンには、グルコ-スの取り込みの阻害作用、HIF活性の阻害作用、PI3K/Akt/mTORシグナル伝達系の阻害作用など、複数の機序でがん細胞のワールブルグ効果を阻害する作用が報告されています。
グルコースはそのままでは細胞膜を通過できないため、特別な膜輸送蛋白質の働きによって細胞膜を通過します。このグルコースを輸送するタンパク質がグルコーストランスポーター (グルコース輸送蛋白)で、がん細胞ではグルコースの取込みを増やすため、このグルコーストランスポーターの発現が過剰に増えています。ミルクシスルに含まれるシリマリンがグルコース輸送蛋白に直接作用してグルコースの取込みを阻害する作用が報告されています。(詳細はこちらへ)
④嫌気性解糖系を阻害する半枝蓮
半枝蓮(はんしれん)は学名をScutellaria barbataと言う中国各地や台湾、韓国などに分布するシソ科の植物です。アルカロイドやフラボノイドなどを含み、抗炎症・抗菌・止血・解熱などの効果があり、中国の民間療法として外傷・化膿性疾患・各種感染症やがんなどの治療に使用されています。黄色ブドウ球菌・緑膿菌・赤痢菌・チフス菌など様々な細菌に対して抗菌作用を示し、さらに肺がんや胃がんなど種々のがんに対してある程度の効果があることが報告されています。
半枝蓮の抗がん作用に関しては、民間療法における臨床経験から得られたものが主体ですが、近年、半枝蓮の抗がん作用に関する基礎研究が多数発表されています。米国のベンチャー企業が半枝蓮の抽出エキスを使って乳がんなどに対する効果を検討しており、有効性が報告されています。基礎研究では、半枝蓮には、がん細胞の増殖抑制作用、アポトーシス(プログラム細胞死)誘導作用、抗変異原性作用、抗炎症作用、発がん過程を抑制する抗プロモーター作用などが報告されています。さらに、がん細胞の嫌気性解糖系を阻害してエネルギー産生を低下させ、がん細胞を死滅させる作用が報告されています。(詳しくはこちらへ)
⑤腫瘍性ピルビン酸キナーゼ-M2を阻害する紫根のシコニン
漢方薬に使われる生薬の「紫根(しこん)」は日本各地や中国・朝鮮半島に自生するムラサキ科の多年草「ムラサキ(Lithospermum erythrorhizon)」の根を乾燥してもので、ナフトキノン誘導体のシコニン、アセチルシコニンなどの紫色色素が含まれています。
紫根あるいはシコニンの抗がん作用には様々な作用機序が報告されていますが、がん細胞のエネルギー産生と増殖・生存において重要な役割を果たしている腫瘍特異的なピルビン酸キナーゼ-M2に対して阻害作用を示すことが報告されています。(Oncogene 30 (42): 4297-4306, 2011)
解糖系の最終段階のホスホエノールピルビン酸をピルピン酸に変換する際に働くのがピルビン酸キナーゼです。ピルビン酸キナーゼ(PK)は、哺乳動物では L型、R型、M1型、M2型と呼ばれる4種類のアイソザイムがあります。 アイソザイムというのは、酵素としての活性はほぼ同じでありながら、タンパク質としては別種(アミノ酸配列が異なる)であるような酵素です。
ピルビン酸キナーゼのアイソザイムは酵素学的な性質と発現の制御機構が異なっています。成体では L型は肝臓、腎臓、小腸、膵β細胞で、R型は赤血球で、M1型は骨格筋、心筋、脳で特異的に発現していますが、M2型は多くの組織に存在します。 胎児期の初期においてはどの組織も M2型のみが発現していますが、組織の分化・発達が進むにつれて上記の組織特異的アイソザイムに置き換わっていきます。 細胞ががん化すると、逆に組織特異的アイソザイムは減少あるいは消失して、M2型が出現あるいは増加します。
ピルビン酸キナーゼ-M2は一つのタンパク質が4つ重合した4量体と、4量体が2つに分かれた2量体があり、2量体になるとホスホエノールピルビン酸をピルビン酸に変換する酵素活性がありません。がん細胞では2量体のピルビン酸キナーゼ-M2が多く発現しており、腫瘍マーカーとしても利用されています。
解糖系の最終段階でピルビン酸に代謝されないと、その上流の代謝産物が蓄積しますが、これらの代謝産物は核酸や脂肪酸やアミノ酸の合成の材料になります。つまり、がん細胞の細胞分裂で増殖するとき、大量のグルコースを取り込み、エネルギー産生と同時に、細胞の構成成分である核酸や脂肪酸やアミノ酸を増やす必要があります。ピルビン酸キナーゼ-M2は、4量体と2量体の比率を変えることによって、エネルギー産生と物質合成の調節を行うことによって、がん細胞の増殖に重要な役割を担っていると言えます。つまり、がん細胞における特徴的なエネルギー産生の複雑なネットワークの中で、腫瘍性のピルビン酸キナーゼ-M2は中心的な役割を担っているのです。
シコニンとその類縁成分が、ピルビン酸キナーゼの腫瘍特異的なアイソフォームであるピルビン酸キナーゼ-M2(PKM2)の阻害剤であり、その中でも特に、シコニンとその光学異性体であるアルカンニン(alkannin)が最も強い阻害活性と特異性を示すことが報告されています。シコニンとアルカンニンを含む紫根は、ピルビン酸キナーゼ-M2を過剰発現しているがん細胞のエネルギー産生と物質合成を阻害して死滅させる効果が期待できます。
(blog:266話参照)
⑥アディポネクチンの産生を刺激する黄蓍(オウギ)
アディポネクチンは脂肪組織から産生される蛋白質です。アディポネクチンは肝臓や筋肉細胞のアディポネクチン受容体に結合すると、これらの細胞内でAMP活性化プロテインキナーゼが活性化されます。AMPKについてはメトホルミンのところで解説しています。AMPKは細胞内エネルギー(ATP)減少を感知して活性化し、糖や脂肪や蛋白質の合成を抑制し、一方、糖や脂肪や蛋白質の分解(異化)を亢進してATPを産生します。黄蓍(オウギ)に含まれるastragaloside IIとisoastragaloside Iは脂肪組織からのアディポネクチンの産生を高める効果があります。アディポネクチンは肝臓や筋肉細胞の受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。がん細胞におけるAMPKの活性化は様々な抗がん作用を発揮します。(blog:292話参照)
⑦ベルベリンのAMPK活性化とαグルコシダーゼ阻害作用
ベルベリンは(berberine) は黄柏(オウバク)や黄連(オウレン)などの生薬に含まれるベンジルイソキノリンアルカロイドの一種です。黄連や黄柏の抽出エキスやベルベリンには、様々な抗がん作用が報告されています。
糖代謝との関連では、ベルベリンにはAMP活性化プロテインキナーゼ(AMPK)を活性化する作用、αグルコシダーゼを阻害する作用が報告されています。AMPKの活性化はインスリン感受性を高め、糖新生を抑制し、糖の消化管からの吸収を抑制します。αグルコシダーゼは腸で働く消化酵素で、糖質をグルコースに分解します。ベルベリンはαグルコシダーゼを阻害して糖質の吸収を抑える効果が期待できます。(blog:291話参照)
以上のように、漢方薬でも、半枝蓮、紫根、黄蓍、黄連、黄柏、冬虫夏草などを多く使うとがん細胞のワールブルグ効果を抑制して中鎖脂肪ケトン食療法の効果を高めることができます。
⑧ピルビン酸脱水素酵素を活性化するジクロロ酢酸ナトリウム
がん細胞におけるミトコンドリアの機能低下は不可逆的なものではなく、可逆的に活性化することもできます。がん細胞で嫌気性解糖系が阻害されると、エネルギー産生をミトコンドリアでの酸化的リン酸化反応に移行せざるを得なくなります。元々がん細胞は抗酸化酵素の発現が低下しているので正常細胞よりも抗酸化力が低い特徴があります。したがって、ミトコンドリアにおける酸化的リン酸化が活性化して活性酸素の産生が高まるとがん細胞内で酸化ストレスが増大し、アポトーシスが起こりやすくなります。実際に、がん細胞で乳酸脱水素酵素を阻害すると、がん細胞の酸化的ストレスが上昇して死滅することが報告されています。
さらに、ピルビン酸脱水素酵素を活性化してピルビン酸からアセチルCoAへの変換を促進してTCA回路を回せば、酸化的リン酸化による活性酸素の産生が増え、酸化ストレスの増大によってがん細胞が死滅することが報告されています。ピルビン酸脱水素酵素を活性化する方法としてジクロロ酢酸ナトリウムとR体αリポ酸があります。
低酸素になると誘導される低酸素誘導性因子(HIF-1)はピルビンン酸脱水素酵素キナーゼの発現を促進してピルビン酸脱水素酵素の活性を低下させます。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素を活性化します。(詳細はこちらへ)
⑨R体αリポ酸
αリポ酸には光学異性体のR体とS体がありますが、ピルビン酸脱水素酵素の補酵素としてこの酵素の活性を亢進するのはR体の方です。S体はむしろ阻害します。通常販売されているαリポ酸は合成されたもので、R体とS体が半々に含まれるラセミ体と言われるものです。抗酸化作用だけであれば、どちらも有効ですが、がん治療に使うときには、R体のみのものを使用しないと効果が期待できません。(詳細はこちらへ)
⑩がん細胞内の鉄と反応してフリーラジカルを産生するアルテスネイト
アルテスネイト(Artesunate)は中国で古くからマラリアなどの感染症の治療に使われていた青蒿(セイコウ:Artemisia annua)というキク科の薬草から分離された成分で、現在ではマラリアの特効薬として使用されています。アルテスネイトは分子の中に鉄イオンと反応してフリーラジカルを産生するendoperoxide bridge を持っています。がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。
がん遺伝子のc-Mycや低酸素状態によって発現が誘導される低酸素誘導性因子1という転写因子はトランスフェリンレセプターの発現を高めています。鉄は細胞増殖に必要なため、がん細胞はトランスフェリンレセプターを多く発現して鉄を多く取り込んでいます。細胞分裂の早いがん細胞ほど鉄を多く取り込んでいると言われています。一方、がん細胞はスーパーオキシド・ディスムターゼ(SOD)やカタラーゼやグルタチオンペルオキシダーゼなどの抗酸化酵素の発現が少なく、酸化ストレスに対する抵抗力(抗酸化力)が低下していると言われています。したがって、がん細胞内の鉄と反応してフリーラジカルを発生するアルテスネイトは、正常細胞を傷つけずにがん細胞に選択的に障害を与えることができるのです。アルテスネイトによってがんや肉腫が縮小した臨床報告があり、人間における腫瘍にたいしても有効であることが証明されています。進行した非小細胞性肺がんの抗がん剤治療にアルテスネイトを併用すると抗腫瘍効果が高まることが、中国で行われたランダム化比較試験で報告されています。
最近の研究では、アルテスネイトは多彩な作用メカニズムで抗腫瘍効果を発揮することが報告されています。がん細胞内でフリーラジカルを産生して酸化ストレスを高める以外に、血管新生阻害作用、DNAトポイソメラーゼIIa阻害作用、細胞増殖や細胞死のシグナル伝達系に影響する作用などが報告されています。(詳細はこちらへ)
ケトン食や嫌気性解糖系を阻害する方法でがん細胞のエネルギー産生を低下させ、がん細胞のTCA回路を活性化して酸化ストレスを増大させると同時に、がん細胞に多く含まれる鉄を利用して酸化ストレスを増大させるアルテスネイトの併用はがん細胞を選択的に死滅させる効果が期待できます。
その他:αグルコシダーゼ阻害薬、消化酵素、L-カルニチン
中鎖脂肪ケトン食では1日の糖質の摂取を50グラム以下に制限することが基本です。ご飯やパンや麺類やイモ類など糖質の多い食品を省いても、大豆や野菜やその他いろんな食品に糖質は含まれています。そこで、食品中の糖質を減らす方法として、糖質を分解する酵素を阻害するという方法があります。糖尿病の治療薬として認可されているαグルコシダーゼ阻害薬を利用してみることも有用です。αグルコシダーゼは小腸粘膜に存在する酵素で、糖質をグルコースに分解する働きがあります。この酵素を阻害すると、糖質の吸収を阻害することができます。
一方、脂肪を多く摂取した場合、脂肪分解酵素(リパーゼ)の分泌が間に合わないと下痢や腹痛の原因になります。そこで、リパーゼを多く含む消化酵素を食後に服用すると、脂肪酸の吸収を助け、胃腸の負担を軽減できます。
中鎖脂肪酸はL-カルニチンの助けが無くてもミトコンドリアに入れますが、長鎖脂肪酸はL-カルニチンと結合しなければミトコンドリアに入れません。L―カルニチンは生体内で生成されていますが、サプリメントで摂取すると脂肪の燃焼を促進する効果が得られます。脂肪を多く摂取するケトン食では、長鎖脂肪の代謝を助ける目的でL-カルニチンのサプリメントも有用です。
●1ヶ月分の費用の目安 :
メトホルミン:3000〜9000円 |
発酵小麦胚芽エキス(AveULTRA): 27000円 |
シリマリン:5000円 |
アルテスネイト:6000〜12000円 |
ジクロロ酢酸ナトリウム:12000円 |
R体αリポ酸&セレン:5000円 |
L-カルニチン:6300〜12600円 |
漢方薬:10000〜30000円 |
中鎖脂肪ケトン食療法とレチノイドなどを併用した「がん細胞の分化誘導と増殖抑制」療法
AMP活性化プロテインキナーゼ、mTORC1、FOXO3Aをターゲットにしたがん治療