トリプル・ネガティブ乳がんの補完・代替医療
【トリプル・ネガティブ乳がんは生物学的悪性度が高く、再発しやすい】
乳がんは均質な疾患ではなく,様々な特徴を持つ複数のサブタイプに分類されます。 一般的には、エストロゲン受容体(ER)、プロゲステロン受容体(PgR)、ヒト上皮細胞増殖因子受容体タイプ2(HER2)の発現量を指標として複数のサブタイプに分類されます。
エストロゲン受容体(ER)とプロゲステロン受容体(PgR)の発現量が多い乳がんは分化度が高く(正常細胞に近い)、ホルモン受容体を発現していない乳がんは一般に分化度が低い(悪性度が高い)と考えられます。
HER2(ヒト上皮細胞増殖因子受容体タイプ2)は、細胞表面に存在する約185 kDaの糖タンパクで、受容体型チロシンキナーゼです。上皮成長因子受容体 (EGFR)に類似した構造をもち、EGFR2やNEUとも呼ばれます。
HER2タンパクは正常細胞において細胞の増殖や生存や分化や移動などの調節に関与していますが、何らかの理由でHER2遺伝子に増幅や変異が起こると下流のシグナル伝達経路が活性化し、がん遺伝子として働くことになります。乳がんや胃がんや卵巣など多くのがんでHER2の遺伝子増幅がみられます。
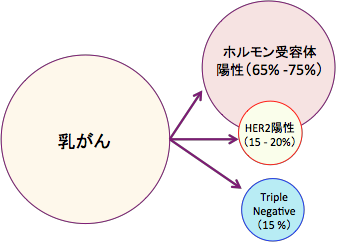
トリプル・ネガティブ(Triple Negative)乳がんというのは、ホルモン受容体(エストロゲン受容体とプロゲステロン受容体)とHER2蛋白を発現していない乳がんです。 トリプル・ネガティブ乳がんは細胞増殖能が高く、遠隔臓器への転移を起こし易く、早期に再発し易い乳がんです。 トリプル・ネガティブ乳がんは原発性乳がんの約15%を占め、乳がんの中でも生物学的悪性度の高いサブタイプと言えます。
図:乳がんには、ホルモン受容体(エストロゲン受容体とプロゲステロン受容体)が陽性の乳がんが65〜75%存在し、ヒト上皮細胞増殖因子受容体タイプ2(HER2)を発現している乳がんが15〜20%存在する。ホルモン受容体とHER2のいずれも発現していない乳がんをトリプル・ネガティブ乳がん(Triple Negative Breast Cancer)と言い、乳がん全体の約15%を占めている。
【トリプル・ネガティブ乳がんは転移すると予後不良】
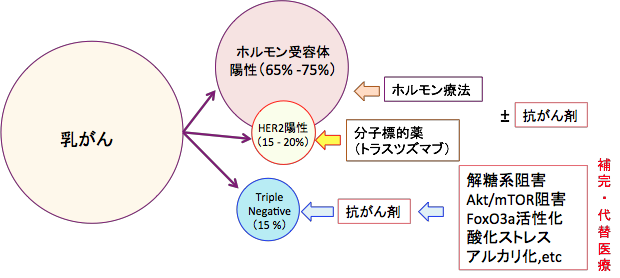
ホルモン受容体が陽性の乳がんはホルモン療法が効きます。
HER2タンパク質が陽性であれば、HER2タンパク質に特異的に結合して抗腫瘍効果を発揮するトラスツズマブ(Trastuzumab)を使った治療が使えます。 トラスツズマブ(商品名:ハーセプチン)はHER2タンパク質に特異的に結合するモノクローナル抗体です。HER2に特異的に結合してHER2の増殖活性を阻害すると同時に、がん細胞に抗体が結合するとNK細胞や単球が抗体が結合したがん細胞を抗体依存性細胞傷害作用によって死滅させることによって抗腫瘍効果を発揮します。
この薬が使用されるまでは、HER2の発現の多いがん細胞ほど増殖が亢進しているので予後が不良でしたが、トラスツズマブ(商品名:ハーセプチン)が使えるようになって、HER2の発現の多いがん細胞の予後は良くなっています。
トリプル・ネガティブ乳がん(Triple Negative Breast Cancer)は、ホルモン受容体やHER2タンパク質が陽性の乳がんと異なり、現時点では明確な「治療の標的」が存在しません。 早期に発見されて転移が無い段階で切除できれば根治します。しかし、遠隔臓器に転移した場合は、ホルモン療法もハーセプチンも使えないため、抗がん剤しか治療法がありません。 通常、アントラサイクリン系やタキサン系の抗がん剤が使われますが、これらの通常の抗がん剤治療では、いずれ耐性ができて治療に抵抗し、予後は不良です。
つまり、トリプル・ネガティブ乳がんが転移・再発した場合は、有効な治療法が少なく、短期にがん死に至る症例が多いことが問題になっています。
図:乳がんの全身治療において、抗がん剤治療以外に、ホルモン受容体が陽性の場合はホルモン療法が使用でき、HER2受容体陽性の場合はHER2タンパク質に対するモノクローナル抗体のトラスツズマブ(ハーセプチン)による治療がある。ホルモン受容体とHER2のいずれも発現していないトリプル・ネガティブ乳がんに対しては抗がん剤治療しか使えない。トリプル・ネガティブ乳がんの抗がん剤治療の抗腫瘍効果を高める補完・代替医療のターゲットとして、解糖系阻害、Akt/mTORシグナル伝達系阻害、転写因子のFoxO3a活性化、がん細胞の酸化ストレス亢進、がん組織のアルカリ化などがある。これらを併用することによって、抗がん剤治療の効果を高めることができる。
【トリプル・ネガティブ乳がんの補完・代替療法】
トリプル・ネガティブ乳がんが転移・再発した場合は、標準治療では抗がん剤治療しかありません。しかし、抗がん剤治療だけでは、多くは数年で死に至ります。そこで、抗がん剤治療の効果を高める補完療法や、通常の抗がん剤治療に代わる代替療法の検討も必要です。
トリプル・ネガティブ乳がんの治療に有効な補完・代替医療は多数ありますが、有効性のエビデンスが高いものから優先的に検討するのが現実的です。① 抗がん剤治療中(手術前、再発時)は、がん幹細胞の抗がん剤感受性を高めることと、がん細胞の酸化ストレスを高める酸化療法、がん組織をアルカリ化する方法(アルカリ療法)を併用することが推奨されます。
具体的には、ジクロロ酢酸ナトリウム、2-デオキシグルコース、メトホルミン、ジスルフィラム、オーラノフィン、プロトンポンプ阻害剤、炭酸水素ナトリウムなどがあります。② 手術後の再発予防の目的では、残っているかもしれない微小な転移の発育を阻止するために、グルコースとインスリンの上昇を防ぐケトン食、血管新生阻害と抗炎症と抗腫瘍免疫の増強が目標になります。
具体的には、ケトン食、COX-2阻害(セレコックス)、ジインドリルメタン、ビタミンD3、漢方薬(免疫増強+抗腫瘍作用)などがあり、再発リスクの高い場合には、メトホルミン、サリドマイド、オーラノフィンなどの追加を検討します。③ 抗がん剤治療が効かなくなって、標準治療で匙を投げられたら、ケトン食をベースにメトロノミック・ケモテラピー(シクロホスファミドなど)に、がん細胞の解糖系を阻害しミトコンドリアを活性化する方法(2-デオキシグルコース、ジクロロ酢酸ナトリウム)、がん細胞の酸化ストレスを高める酸化療法(メトホルミン、ジスルフィラム、オーラノフィン、アルテスネイトなど)、がん組織をアルカリ化する方法(プロトンポンプ阻害剤、炭酸水素ナトリウム)、漢方薬(免疫増強+抗腫瘍作用)などがあります。
経験的に、悪性度の高いがんは、一つや二つの治療法ではほとんど効果が期待できません。 がん細胞の生存と増殖を阻止するためには、複数のターゲットを同時に攻める必要があります。それでも、がん細胞は死滅しない可能性もあります。しかし、何らかの方法でがん細胞の増殖と生存を阻止するしかありません。
標準治療の最大耐用量の抗がん剤治療も、ただ抗がん剤を投与するだけでなく、がん細胞の抗がん剤感受性を高める方法を積極的に併用すれば、抗腫瘍効果を高めることができます。
最大耐用量の抗がん剤治療だけでは、転移したトリプル・ネガティブ乳がん患者さんはほぼ確実に数年以内に亡くなります。
トリプル・ネガティブ乳がんで死なないためには、治療の早い段階から、エビデンスに基づいた補完・代替医療を利用することが重要です。 複数のレジメの抗がん剤治療を受け、抗がん剤がもう効かないという段階になると、これらの補完・代替医療の効果は極めて限定的です。
がん患者さんの多くは、標準治療で匙を投げられてから代替療法を探しますが、特に治療抵抗性のトリプル・ネガティブ乳がんの場合は、治療の開始時点で適切な補完・代替医療を検討すべきだと思います。 このサイトで推奨している補完・代替医療のエビデンスを以下に解説します。
【トリプル・ネガティブ乳がん細胞は解糖系の亢進が強い】
がん細胞のエネルギー代謝の特徴は、解糖系が亢進し、ミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制されていることです。 がん細胞は酸素が十分に存在する状況でも、できるだけ酸素を使わないエネルギー代謝を使っています。これをワールブルグ効果と言います。
トリプルネガティブ乳がん細胞では、他のサブタイプの乳がんと比較して、特に解糖系が亢進していることが報告されています。 つまり、エストロゲン受容体陽性細胞と比べて、トリプル・ネガティブ乳がん細胞では、グルコースの取込みと乳酸産生がより亢進し、ミトコンドリアでの酸化的リン酸化が低下しています。
したがって、グルコースの取込みと解糖系を阻害する治療法はトリプル・ネガティブ乳がん細胞の治療において有効性が高いことが示唆されます。 グルコース取り込みと解糖系を阻害する治療法としてはケトン食と2-デオキシ-D-グルコースがあります。
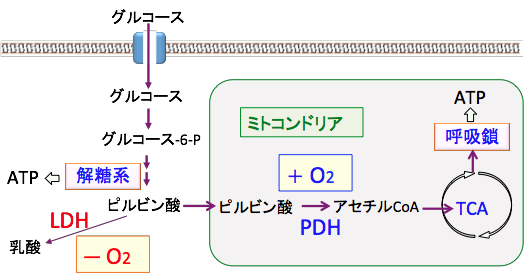
がん細胞では乳酸脱水素酵素A(LDH-A)の発現と活性が亢進しています。 細胞内に取り込まれたグルコースは、解糖系で代謝されてピルビン酸まで分解されます。その後、正常細胞では、酸素が使える状況ではピルビン酸はミトコンドリアに入り、ピルビン酸脱水素酵素によってアセチルCoAに変換されてTCA回路でさらに代謝されます。
低酸素の状況では、ピルビン酸は細胞質で乳酸脱水素酵素(LDH)によって乳酸に変換されます。 一方がん細胞では、酸素が十分に使える状況でも、ミトコンドリアでの酸素呼吸(酸化的リン酸化)が抑制されており、ピルビン酸はミトコンドリアに入らずに、細胞質内の乳酸脱水素酵素によって乳酸に変換されます。
図:グルコースが解糖系でピルビン酸まで分解されたあと、酸素があればミトコンドリアでピルビン酸脱水素酵素(Pyruvate Dehydrogenase; PDH)によってアセチルCoAに変換されてTCA回路でさらに代謝され、電子伝達系(呼吸鎖)でATPが産生される。酸素が無い条件では、ピルビン酸は乳酸脱水素酵素(Lactate Dehydrogenase; LDH)によって乳酸に変換される。がん細胞では、LDHの活性が亢進し、PDHの活性は抑制されており、酸素が十分に使える状況でも、ミトコンドリアでの酸素呼吸(酸化的リン酸化)は抑制され、乳酸産生が亢進している。
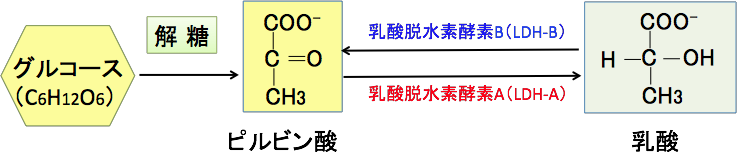
LDHにはLDH-AとLDH-Bの2つのサブタイプがあります。
LDH-Aは骨格筋タイプあるいはLDH-Mとも言い、ピルビン酸から乳酸の変換に適しています。骨格筋では通常は有酸素でミトコンドリアでの代謝が中心ですが、短距離ダッシュのような無酸素での運動では骨格筋で嫌気性解糖によるエネルギー産生が起こるのでLDH-Aが必要になります。
一方、LDH-Bは心臓タイプあるいはLDH-Hとも言い、乳酸からピルビン酸の変換に適しています。心臓では、血中の乳酸もエネルギー源に利用するので、乳酸からピルビン酸に変換するLDH-Bが必要になります。図:乳酸脱水素酵素(LDH)はピルビン酸から乳酸への変換を促進するLDH-Aと、乳酸からピルビン酸への変換を促進するLDH-Bの2つのタイプがある。がん細胞ではLDH-Aの発現と活性が亢進している。
LDH-Aはがん治療のターゲットになります。それは好気性解糖(ワールブルグ効果)が亢進しているがん細胞ではLDH-Aの発現が亢進しているのに対して、正常細胞では骨格筋にしか発現していないためです。
LDH-Aは骨格筋で嫌気性解糖を行うときしか必要ないので、短距離ダッシュのように無酸素の運動をしなければ、LDH-Aは正常細胞では無くても構わないと言えます。実際にLDH-Aの遺伝子が欠損していても、大した異常は起こらないことが報告されています。
多くのがん細胞でLDH-Aの発現亢進が認められています。LDH-Aは低酸素誘導因子-1(HIF-1)によって発現が誘導されます。がん細胞ではHIF-1の発現が亢進しており、LDH-Aの発現が亢進しています。
LDH-A(乳酸脱水素酵素A)は正常細胞の働きには必要性は低いので、LDH-Aの発現や活性を阻害することはがん治療のターゲットとして有望と考えられています。
ジクロフェナクは商品名がボルタレンというポピュラーな消炎鎮痛剤ですが、LDH-Aをターゲットにして解糖系を阻害する作用が報告されています。
さらにLDHは低酸素誘導因子-1(HIF-1)によって発現が誘導されるので、低酸素誘導因子-1(HIF-1)の発現や活性を抑制するラパマイシン、ジインドリルメタン、ヘキソキナーゼ活性を阻害する2-デオキシグルコースなどを併用してがん細胞の解糖系を阻害する方法を組み合せると抗腫瘍活性を高めることができます。
【糖尿病治療薬メトホルミンは乳がん細胞の抗がん剤感受性を高める】
がん細胞が増殖するためには、増殖のシグナルと、エネルギー産生と物質合成のための材料が必要です。
増殖シグナル伝達系は、インスリン/インスリン様成長因子-1(IGF-1)とそれらの受容体の結合によって刺激されるPI3K/Akt/mTORC1伝達系が重要です。
トリプル・ネガティブ乳がん細胞ではAktシグナル伝達系の活性が亢進しており、治療のターゲット分子として注目されています。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)と解糖系のヘキソキナーゼを阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を抑制します。
メトホルミンが乳がんの抗がん剤治療の奏功率を高めることが報告されています。Metformin in early breast cancer: a prospective window of opportunity neoadjuvant study.(早期乳がんにおけるメトホルミン:好機術前補助療法の前向き試験) Breast Cancer Res Treat. 135(3):821-30. 2012
この研究では、糖尿病でない乳がん患者にメトホルミンを1日1500mg(1回500mgを3回)投与しています。投与期間は中央値が18日(13~40日)と比較的短期間の投与ですが、臨床症状や血液検査で、抗がん作用を示唆する結果が得られています。
メトホルミンは2型糖尿病の治療薬ですが、インスリンの分泌を促進するのではなく、細胞のインスリン感受性を高める(インスリン抵抗性を改善する)作用なので、糖尿病でなくても血糖を下げ過ぎることは無いので、1日1500mgでも問題ないようです。
メトホルミンは様々ながんの発生率を低下させることが報告され、さらに抗がん剤治療や放射線治療の効き目を高めることが報告されています。さらに、メトホルミン自体に抗がん作用が報告されています。
トリプル・ネガティブ乳がんの抗がん剤治療において1日500mgから1500mgの間で副作用の出ない範囲でメトホルミンを服用することはある程度のエビデンスがあると言えます。
【ビタミンD3+メトホルミン+ケトン食が乳がんに効く可能性がある】
ビタミンDの血中濃度が高いほど、乳がんの生存率が良くなることが大規模疫学研究で明らかになっています。 トリプル・ネガティブ乳がんでは特に血中ビタミンD濃度が低いというデータが報告されています。
Triple negative breast cancer patients presenting with low serum vitamin D levels: a case series(血清ビタミンD濃度が低値を示すトリプル・ネガティブ乳がん:ケースシリーズ)Cases J. 2009; 2: 8390.
一般にがん患者は血清中のビタミンD濃度(貯蔵型の25-ヒドロキシビタミンDで測定)が低値を示すことが明らかになっています。
この論文では15例のトリプル・ネガティブ乳がんを対象に25-ヒドロキシビタミンDの血清中の濃度を測定し、健常人や他のサブタイプの乳がん患者と比較しています。解析の結果、トリプル・ネガティブ乳がん患者では特にビタミンDの血清中濃度が低いという結果を示しています。
トリプル・ネガティブ乳がん患者は積極的にビタミンDのサプリメントを補充することが有用と言えます。
再発予防や進行乳がんでビタミンD3のサプリメントの大量摂取が代替医療ではポピュラーです。以下のような症例報告があります。Effects of Pre-surgical Vitamin D Supplementation and Ketogenic Diet in a Patient with Recurrent Breast Cancer.(再発乳がん患者における術前のビタミンD補充とケトン食の効果)Anticancer Res. 2015 Oct;35(10):5525-32.
これは1例の症例報告ですが、高用量(1日10,000 IU)のビタミンD3とケトン食の併用が乳がんに効く可能性を示唆しています。
また、ビタミンD3とメトホルミンの相乗効果は乳がんや前立腺がんや大腸がんなどで報告されています。
メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化してAkt/mTORシグナル伝達系を阻害し、がん細胞の増殖を抑制します。ビタミンD3はメトホルミンの抗腫瘍効果を高めます。次のような報告があります。Synergistic antitumor activity of vitamin D3 combined with metformin in human breast carcinoma MDA-MB-231 cells involves mTOR related signaling pathways. (ヒト乳がん細胞MDA-MB-231細胞におけるビタミンD3とメトホルミンの併用による相乗的な抗腫瘍効果はmTOR関連のシグナル伝達系が関与する)Pharmazie. 2015 Feb;70(2):117-22.
メトホルミンは2型糖尿病の治療に使用されていますが、最近の多くの研究によって、メトホルミンとビタミンDは多くのがん細胞に対して抗腫瘍効果を示すことが示されています。
この研究では、ヒト乳がん細胞株MDA-MB-231を用いて、ビタミンD3とメトホルミンの併用はアポトーシス誘導において相乗効果があることを報告しています。その抗腫瘍効果の発現にはmTOR関連のシグナル伝達系が関与することを報告しています。 つまり、ビタミンD3とメトホルミンはmTOR(哺乳類ラパマイシン標的蛋白質)の活性を阻害することによってアポトーシスを誘導することを示しています。
進行した乳がんの代替医療として、高用量(1日4000~10000国際単位)のビタミンD3とメトホルミン(1日1000~1500mg程度)とケトン食の組合せは、相乗効果が期待できると考えられます。ビタミンD3もメトホルミンも安価ですので、試してみる価値は高いと言えます。 この組合せは乳がんだけでなく、大腸がんや膵臓がんや肺がんなど他のがんにも効果が期待できます。
【断酒薬のジスルフィラムはトリプル・ネガティブ乳がん細胞の抗がん剤感受性を高める】
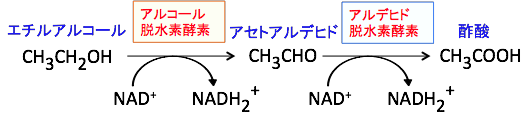
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です(下図)。
アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っているのです。 細胞内ではアミノ酸やアルコールや脂肪酸やビタミンの代謝の過程でアルデヒドが発生します。アルデヒド脱水素酵素はこれらのアルデヒドを解毒する働きがあります。
ALDH1にはALDH1A1とALDH1A2とALDH1A3の3つのアイソタイプがあります。 マウスやヒトの細胞を用いた研究では、とくにALDH1A1アイソタイプの過剰発現および活性亢進は、乳がん、肺がん、食道がん、大腸がん、胃がんなど多くのがん種で、がん患者の予後不良と密接に関連していることが明らかになっています。
トリプルネガティブ乳がん細胞でも、ALDH1の発現が予後不良の要因となることが報告されています。Aldehyde dehydrogenase 1 expression predicts poor prognosis in triple-negative breast cancer.(アルデヒド脱水素酵素1の発現はトリプルネガティブ乳がん患者の予後不良を予測する) Histopathol, 59 , 776-80, 2011
さらに、トリプルネガティブ乳がん細胞は他のタイプの乳がん細胞よりもALDH1発現が高く、これが抗がん剤が効きにくい理由という意見もあります。
Platinum-based chemotherapy in triple-negative breast cancer: a meta- analysis. (トリプルネガティブ乳がんにおける白金製剤をベースにした抗がん剤治療:メタ解析)Oncol Lett 5 , 983-91.2013
20年以上前に、白血病などの造血器腫瘍で、ALDHの活性が高い細胞はアルキル化剤のシクロフォスファミドに抵抗性を示すことが報告され、その後、ALDHの活性が高いがん細胞は多くの抗がん剤や放射線照射に抵抗性になることが明らかになっています。
ALDH1A1は細胞内のアルデヒドを酸化することによってがん細胞内の酸化ストレスを軽減しています。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは副作用の極めて少ない薬です。 アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです。
ジスルフィラムはALDH1A1を阻害します。その他、ジスルフィラムはプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。酸化ストレスを高める作用もあります。
乳がんのがん幹細胞はアルデヒド脱水素酵素の発現が亢進していることが報告されています。 ジスルフィラムが抗がん剤抵抗性を軽減する効果はトリプル・ネガティブの乳がん細胞でも示されています。 以下のような報告があります。Disulfiram targets cancer stem-like cells and reverses resistance and cross-resistance in acquired paclitaxel-resistant triple-negative breast cancer cells(ジスルフィラムはがん幹細胞をターゲットにして抗がん剤耐性を阻止し、パクリタキセルに対する耐性を獲得したトリプルネガティブ乳がん細胞の交叉耐性を阻止する)Br J Cancer. 2013 Oct 1; 109(7): 1876–1885.
トリプルネガティブ乳がん細胞は予後不良で、その主な理由は抗がん剤に耐性を獲得して、治療が失敗に終わることが多いためです。このような抗がん剤耐性のがん細胞は一つの抗がん剤に対してだけでなく、耐性のメカニズムが異なる複数の抗がん剤に対しても耐性になっていることが多く経験されます。 このような複数の抗がん剤に対する交叉耐性を阻止する方法は、抗がん剤の治療効果を高めます。
この論文では、ジスルフィラムががん幹細胞の性質をもったがん細胞の抗がん剤耐性を阻止し、さらに複数の抗がん剤に対する耐性を阻止することを報告しています。 つまり、トリプルネガティブ乳がん細胞の抗がん剤感受性を高める方法としてジスルフィラムは有効という結論です。 以下のような報告もあります。Disulfiram induces anoikis and suppresses lung colonization in triple-negative breast cancer via calpain activation.(ジスルフィラムはトリプルネガティブ乳がん細胞においてカルパインの活性化によってアノイキスを誘導し肺への転移を抑制する)Cancer Lett. 2017 Feb 1;386:151-160.
上皮細胞は細胞や細胞外基質と接着して増殖し、浮遊状態では増殖できず細胞死が誘導されます。このような足場を失ったことで誘導される細胞死をアノイキス(anoikis)と呼びます。 がん細胞ではさまざまな分子メカニズムによりアノイキスに抵抗性となり、血管内などで細胞死を免れ,転移が可能になります。ジルスフィラムはがん細胞のアノイキスを誘導して転移を抑制するという実験結果です。カルパインは蛋白分解酵素の一種です。
がん細胞の抗酸化システムを阻害するような他の薬をジスルフィラムと併用すると、ジスルフィラムの抗腫瘍活性を高めることができると予測できます。 リュウマチ治療薬のオーラノフィン(Auranofin)はチオレドキシン還元酵素(thioredoxin reductase)の活性を阻害する作用を有するので、ジスルフィラムの抗腫瘍効果を増強する効果が期待できます。 トリプルネガティブ乳がんの抗がん剤治療にジスルフィラムとオーラノフィンを併用する価値はあります。注:ジスルフィラム服用中は飲酒はできません。奈良漬けのようなアルコールの入った食品も食べれません。抗がん剤のパクリタキセルは溶解剤としてエタノールを用いていますので、パクリタキセル治療中はジスルフィラムは使用できません。点滴による抗がん剤治療を受けているときには、溶解剤などでエタノールを使用していないことを確認する必要があります。 エタノールを摂取しなければ、副作用はほとんど経験しません。
【CB2受容体の選択的アゴニストはトリプル・ネガティブの乳がんの増殖を抑える】
カンナビノイド受容体CB2の選択的アゴニストの抗がん作用も注目されています。以下のような論文があります。
Selective, Nontoxic CB2 Cannabinoid o-Quinone with in Vivo Activity against Triple-Negative Breast Cancer.(トリプル・ネガティブの乳がんに対してin vivoで抗腫瘍活性を示す非毒性のCB2の選択的アゴニストのo-Quinone)J Med Chem. 58(5):2256-64. 2015年
この論文ではカンナビノイド受容体タイプ2(CB2)の選択的アゴニストを合成し、ヒトのトリプル・ネガティブの乳がん細胞をマウスに移植するin vivoの実験モデルで抗腫瘍効果を検討していマス。 このCB2選択的アゴニスト作用を示す物質は、ヒトのトリプル・ネガティブの乳がん細胞の培養細胞に細胞死を誘導しましたが、正常な乳腺上皮細胞には毒性を示しませんでした。 この論文では、CB2選択的アゴニストはトリプル・ネガティブ乳がんの治療に効果が期待できるという結論です。
CB2の選択的アゴニストとしてβ-カリオフィレンがあります。ベータ・カリオフィレン(β-caryophyllene)は、多くの香辛料や植物性食品の精油に含まれるセスキテルペンです。 日本(厚生労働省)も米国(食品医薬品局)も食品添加物として認可していますので、極めて安全性の高い天然成分です。(βカリオフィレンについてはこちらへ)
【カンナビジオールはトリプル・ネガティブの乳がんの治療に役立つ可能性がある】
カンナビジオール(CBD)はΔ9-テトラヒドロカンナビノール(THC)と並んで大麻の主要なカンナビノイドです。 CBDはカンナビノイド受容体のCB1とCB2には作用しないため、精神作用はありません。その他の受容体(セロトニン受容体の5-HT1Aなど)やイオンチャネル(TRPV1など)に作用して多彩な作用を発揮します。
カンナビジオールはTHCとは異なる作用機序で乳がん細胞の増殖を抑制することが報告されています。以下のような報告があります。Modulation of the tumor microenvironment and inhibition of EGF/EGFR pathway: novel anti-tumor mechanisms of Cannabidiol in breast cancer.(腫瘍組織の微小環境の調整とEGF/EGF受容体経路の阻害:乳がんにおけるカンナビジオールの抗腫瘍効果の新規のメカニズム)Mol Oncol. 9(4):906-19. 2015年
がん組織に浸潤したマクロファージをTAM(tumor-associated macrophage;腫瘍関連マクロファージ)と言い、血管新生、増殖因子産生、免疫抑制、転移促進などのさまざまな機能により発がん・悪性化を促進する働きをしています。
以前は、マクロファージが活性化するとがん細胞を攻撃してくれると考えられていたのですが、むしろ逆で、腫瘍内にマクロファージの数が多いほど予後が悪いことが報告されています。 活性化したマクロファージから産生されるプロスタグランジンE2や炎症性サイトカインはがん細胞を悪化させ、抗腫瘍免疫を抑制してがん細胞の増殖を促進し、転移や再発を促進することが明らかになっています。
この論文では、乳がん細胞がGM-CSF(顆粒球・マクロファージコロニー刺激因子)やケモカインのCCL3を産生して腫瘍関連マクロファージをがん組織内に動員するのをカンナビジオールが抑制する作用を指摘しています。 カンナビジオールはこのようながん細胞の増殖を促進するような微小環境を変えて、がん細胞の増殖や悪性進展を阻止する作用が期待できるということです。 カンナビジオールとカンナビノイド受容体CB2の選択的アゴニストのβ-カリオフィレンの併用は、トリプル・ネガティブ乳がんの治療に有用と思われます。(カンナビジオールについてはこちらへ)
【FoxO3aの活性化は多くのがんで有効】
FOXO3は、動物や人間において、細胞周期、DNA傷害とストレス応答、老化と寿命、細胞のアポトーシス、がん抑制などに関わる遺伝子の発現を制御している転写因子です。FOXO3aを活性化すると多くのがん細胞の抗がん剤感受性を高めることが知られています。以下のような報告があります。
Pharmacological activation of FOXO3 suppresses triple-negative breast cancer in vitro and in vivo (FOXO3の薬理学的活性化は培養細胞および動物実験の両方でトリプルネガティブ乳がんの増殖を抑制する)Oncotarget. 2016 Jul 5; 7(27): 42110–42125.
FDA(米国食品医薬品局)が認可した医薬品をFOXO3の転写活性の亢進を指標にしてスクリニーニングした結果、ベプリジルとトリフルオペラジンのFOXO3活性化作用を認めました。 そして、培養細胞を用いたin vitroの実験と乳がん細胞を移植したマウスを用いたin vivoの実験系の両方で、この2つの薬はトリプルネガティブ乳がんに対して強い抗腫瘍活性を示しました。 PI3K/Akt や IKK/NF-kBシグナル伝達系が過剰に活性化しているトリプルネガティブ乳がんの治療法としてFOXO3転写活性を高める方法は有望と考えられています。
Reprogramming ovarian and breast cancer cells into non-cancerous cells by low-dose metformin or SN-38 through FOXO3 activation(低用量のメトホルミンあるいはSN-35はFOXO3活性化を通して卵巣がん細胞と乳がん細胞を非がん細胞に再プログラムする)Sci Rep. 2014; 4: 5810.
FOXO3を活性化すると卵巣がんや乳がんのがん細胞が非がん細胞に変わるという論文です。 FOXO3を活性化する方法として、低用量のメトホルミンとSN-38を紹介しています。
低用量のメトホルミンあるいはSN-38を投与するとFOXOの核内集積が増加し、DNAダメージマーカーが増え、がん幹細胞のマーカー(CD44、Nanog、Oct-4、c-Myc)が減少することを示しています。 これらの薬は3次元細胞培養における細胞塊(スフェロイド)形成を阻害しました。しかし、FOXO3遺伝子の発現を阻害するとこれらの作用は消失しました。
以上の結果は、低用量のメトホルミンあるいはSN-38は、FOXO3の活性化を介して、がん細胞の正常を非がん細胞に変換することを示しています。 FOXO3を活性化することはがん幹細胞の性状や能力を消失させることになります。それで、「非がん細胞への再プログラム化」という言葉を使っています。
メトホルミンは糖尿病治療薬で、グリオブラストーマなどのがん細胞を用いた研究でFOXO3を活性化することが報告されています。 SN-38は塩酸イリノテカン(CPT11)の活性型です。CPT-11はプロドラッグであり、まず体内で肝臓に存在するカルボキシルエステラーゼによって強力な抗がん作用をもったSN-38に分解され全身に運ばれて抗がん作用を発揮します。トポイソメラーゼ-1阻害活性を示します。 プロドラッグのCPT11は培養細胞に添加しても活性を示さないので、SN-38を使っています。
これら2つの薬は、乳がん細胞と卵巣がん細胞で低用量でFOXO3を活性化し、がん細胞の特徴を消失させることを報告しています。 低用量というのは、in vitroの実験でmetformin (100 μM) 、 SN-38 (1 nM)です。 in vivoの実験でmetformin [5 mg/kg body weightd per mouse], SN-38 (10 μg/kg BW/mouse), 週3回で投与です。メトホルミンとSN-38は注射で投与しています。メトホルミンのマウスで1日に5mg/kgの注射投与は、人間では1mg/kg程度ですが、内服の生体内利用率を考えると5mg/kg程度かもしれません。60kgで300mgですので、通常の250mg製剤を1日1〜2錠で良いように思います。通常の抗がん剤治療は、副作用に耐えられる最大量(最大耐用量)の抗がん剤を投与します。しかし、この方法は固形がんにはあまり有効ではありません。副作用が強く、抗がん剤耐性がん細胞の出現を促進します。 低用量の抗がん剤や、副作用が少なくて抗腫瘍活性を示す薬などを組み合せたメトロノミック・ケモテラピーの方が延命効果が高いという報告もあります。
このメトロノミック・ケモテラピーにおいて、FoxO3aの活性化の併用は有効です。
メソトレキセート、シクロフォスファミド、ジスルフィラム、セレコックスなどを使ったメトロノミック・ケモテラピーに、FoxO3aを活性化する作用があるオーラノフィン、ビタミンD3、イソトレチノイン、サリドマイドなどを組み合せた治療法は、他に治療法が無くなった場合の代替医療として試してみる価値はあります。 あるいは、通常の抗がん剤治療にFoxO3aを活性化する方法を併用する根拠はあると思います。 いずれの薬も比較的安価で、副作用も少なく、抗腫瘍効果も証明されています。 FOXO3aを活性化する方法はこちらのサイトで解説しています。
【果物や蜂蜜はがん細胞を悪化する】
果物や蜂蜜が健康に良いと思っている人は多いようです。がん患者さんの中にも、果物や蜂蜜は多く摂取しても問題ないと思っている人は結構います。しかし、「甘い果物や蜂蜜の摂取はがんの進行を促進する」というエビデンスは多くあります。
血糖を高める(グリセミック指数の高い)ショ糖(スクロース)とブドウ糖(グルコース)と、肥満とがん細胞の増殖を促進する果糖(フルクトース)が多く含まれるからです。
グリセミック指数の高い食事、特に甘い(砂糖や果糖ブドウ糖液糖などを加えた)食品や飲料が乳がんの発症リスクを高めることが報告されています。
フルクトースの細胞内への流入に必要はトランスポーター(輸送担体)であるGLUT5は乳腺の正常細胞でも発現していませんが、乳がん細胞ではGLUT5が過剰発現しているという報告があります。つまり、乳がんでグルコースと同様にフルクトースも多く利用していることを示しています。
多くのがん細胞でグルコースの取込みを担うGLUT1が過剰に発現しており、さらにフルクトースを取り込むGLUT5の発現も増えているのです。
さらに、乳がん細胞の培養液にフルクトースを添加すると、乳がん細胞の性状がより悪化することが報告されています。 細胞内にはタンパク質に糖が結合した糖タンパク質が多数存在しますが、その結合した糖の種類によって蛋白質の性状が変わります。それは、レクチンという接着蛋白質に対する親和性が糖の種類によって変化するからです。乳がんの培養細胞にフルクトースを添加して培養すると浸潤や転移が亢進したという報告があります。
フルクトースが多いとがん細胞内でトランスケトラーゼという酵素が誘導され、解糖系から分かれて核酸(DNAやRNA)合成に必要なペントース・リン酸回路を促進するという報告があります。DNAやRNAの合成が促進することはがん細胞の増殖に有利になります。
その他、飲料水にフルクトースを添加するなどの方法でフルクトースの摂取量を増やすと、化学発がん剤による発がんが促進されるという動物発がんの実験や、がん組織の発育が促進されるという移植腫瘍を用いた動物実験の結果なども報告されています。 蜂蜜や甘い果物には、フルクトースとグルコースが一緒に含まれています。フルクトースはインスリンの分泌を少ししか刺激しませんが、グルコースと一緒に摂取してグルコースによってインスリン分泌が亢進すると、フルクトースのがん促進効果はさらに増強されます。
つまり、フルクトースとグルコースの摂取量が多いと、相乗的にがん細胞の増殖を促進することになり、果物や蜂蜜に含まれる糖分(グルコースとフルクトースを含む)はご飯やパン(グルコースのみ)よりもがんを促進する作用が強い可能性があると言えます。
最近の果物は糖度を高めるように品種改良され、甘い果物ほど売れています。しかし、甘い果物ほど健康に悪いということを理解しておく必要があります。 果糖の取り過ぎは乳がんを含めてがんには良くないと考えるべきです。
当院では多数の補完・代替療法を実践しています。それぞれの治療法の根拠や有効性を示すために、このホームページ内で詳しく解説しています。しかし、がんの種類や進行度や治療の状況によって最適な治療法は異なります。それぞれの治療法を理解し、自分に合った治療法を選択することは、患者さんには困難だと思います。
現在の病状や治療の状況をメール(info@f-gtc.or.jp)か電話(03-5550-3552)かファックス(03-3541-7577)でお知らせいただければ、全て院長(福田一典)がお答えしています。ご来院いただければ、詳しくご説明いたします。