メトホルミンの抗がん作用
【糖尿病治療薬メトホルミンは解糖系とミトコンドリアでATP産生を阻害する】
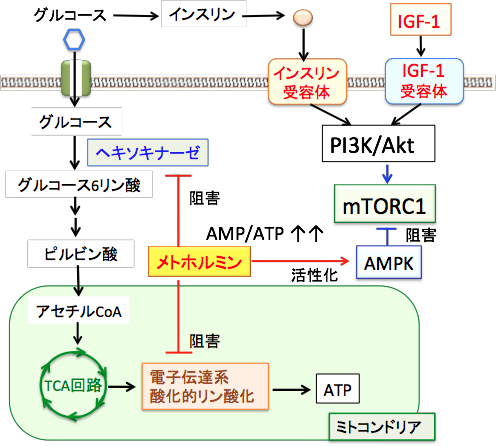
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。糖尿病だけでなくがんの予防や治療の分野でも注目されており、がんの発生を予防する効果やがん細胞の抗がん剤感受性を高める効果が報告されています。 ATP産生を阻害する効果や、がん細胞の増殖を抑える様々な効果を有するAMP活性化プロテインキナーゼ(AMPK)を活性化する効果や、インスリンの分泌を低下させる作用など、多彩な抗腫瘍効果を持ちます。
ビグアナイド剤は、中東原産のマメ科のガレガ(Galega officinalis)から1920年代に見つかったグアニジン誘導体から開発された薬です。ガレガは古くから、糖尿病と思われる病気(口渇や多尿)の治療に経験的に使われ有効性が認められており、その関係でこのガレガから血糖降下作用のあるビグアナイドが発見されました。
メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を介した細胞内シグナル伝達系を刺激することによって糖代謝を改善します。すなわち、筋・脂肪組織においてインスリン受容体の数を増加してインスリン作用を増強し、グルコースの取り込みを促進します。さらに肝臓に作用して糖新生を抑え、腸管でのグルコース吸収を抑制する作用があります。 これらの作用はインスリンの血中濃度を低下させます。
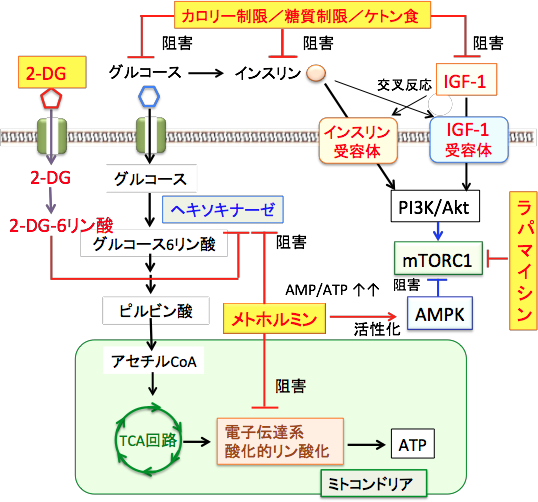
インスリンはがん細胞の増殖を促進するので、インスリンの血中濃度を減らすだけで、がん細胞の増殖を抑制する効果があります。 さらに、AMPKはインスリンおよびインスリン様成長因子-1(IGF-1)によって活性化されるPI3K/Akt/mTORC1シグナル伝達系のmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性を抑制します。また、脂質合成を阻害する作用もあります。がん細胞が分裂して数を増やすためには細胞膜に必要な脂質の合成を増やす必要があります。したがって、がん細胞では脂質合成が亢進しており、脂質合成の阻害剤は抗がん剤として有効であることが報告されています。
メトホルミンはミトコンドリアの呼吸酵素複合体1(電子伝達複合体1)を阻害してATPの産生を減らし、そのためにAMP:ATP比が上昇するためにAMPKが活性化されます。つまり、メトホルミンはミトコンドリア毒であり、この毒を適量使うと血糖を低下させることができるという訳です。 最近の研究では、メトホルミンは、解糖系でグルコースをグルコース-6-リン酸へ変換するヘキソキナーゼを阻害する作用が報告されています。2-デオキシ-D-グルコースと類似の作用です。
つまり、メトホルミンは解糖系とミトコンドリアの両方でATP産生を阻害し、がん細胞のエネルギー産生を直接抑制すると同時に、AMPKを活性化して抗腫瘍効果も発揮します。
メトホルミンはミトコンドリアの電子伝達系の呼吸酵素を阻害する作用と解糖系のヘキソキナーゼを阻害する作用によってATPの産生を減らし、AMP/ATP比が増加することによってAMP活性化プロテインキナーゼ(AMPK)が活性化される。AMPKはインスリンやインスリン様成長因子-1(IGF-1)によって活性が亢進するmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制する。
【AMPKは細胞内のエネルギーセンサー】
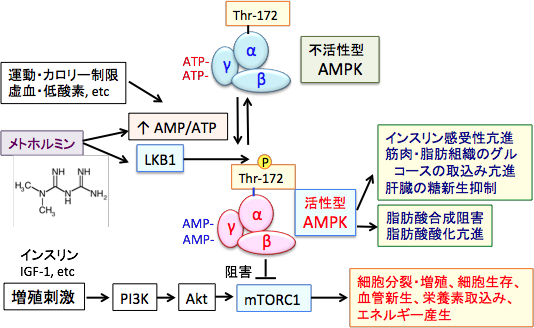
AMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)は人から酵母まで真核細胞に高度に保存されているセリン/スレオニンキナーゼ(セリン/スレオニンリン酸化酵素)の一種で、細胞内のエネルギーのセンサーとして重要な役割を担っています。 AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化されます。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。 その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1(Liver Kinase B1)に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます( 下図)。 リン酸化されたAMPKはmTORC1を抑制し、タンパク質や脂肪酸の合成を低下させてがん細胞の増殖を抑制します。つまり、LKB1はAMPKを活性化する作用によってがん細胞の増殖を抑制する作用があるがん抑制遺伝子になります。 AMP/ATP比を上昇させてAMPKを活性化するメトホルミンががん予防効果や抗がん作用を示す主要なメカニズムがAMPKの活性化です。 しかし、肺がんや子宮内膜がんなど多くのがんでLKB1遺伝子の変異が認められ、機能が失活しています。つまり、LKB1遺伝子に変異がある場合は、メトホルミンの抗腫瘍効果は減弱することになります。
AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っている。AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化される。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される。 LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化する。 リン酸化されたAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制する。
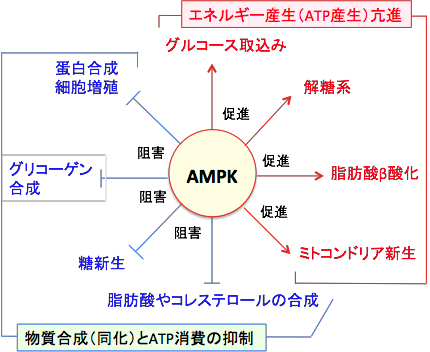
細胞内ATPの減少を感知して活性化したAMPKは、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる作用があります。すなわち、AMPKが活性化すると糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生されます(図)。物質合成が抑制されることは細胞の増殖が抑制されることになります。
AMP活性化プロテインキナーゼ(AMPK)の代謝調節作用。AMPKはATPの減少を感知して活性化され、物質合成(同化)とATP消費を抑制し、ATP産生を亢進して、細胞内ATP量を増やす作用がある。物質合成が抑制されるので、がん細胞の増殖も抑制される。
【臨床試験で証明されたメトホルミンの抗がん作用】
インスリン抵抗性を改善することは老化やがんの予防に有効であるため、メトホルミンはがん予防や抗老化の薬としても注目されています。メトホルミンの抗がん作用に関する基礎研究は1970年代から行われており、2000年代には動物発がん実験でメトホルミンの発がん予防効果が報告されています。 メトホルミンの抗がん作用のメカニズムに関して多くの報告があります。
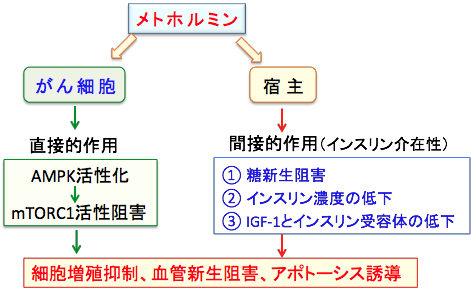
がん細胞に対する直接作用はAMPK活性化とmTORC1の活性阻害によって増殖抑制や血管新生阻害作用を発揮します。宿主に対する間接的な抗腫瘍効果としてはインスリン感受性を高めることによって糖新生を阻害したり、インスリンやインスリン受容体やインスリン様成長因子-1(IGF-1)を低下させる作用が抗腫瘍的に作用します(下図)。
メトホルミンはがん細胞に対する直接的作用とインスリンを介した間接的な作用など、様々なメカニズムで抗がん作用を発揮する。
人間でのがん予防効果が最初に指摘されたのは2005年の論文で、2型糖尿病患者でメトホルミンを服用しているグループは全てのがんの発生率が低下することが後向きケース・コントロール研究で報告されています(British Medical Journal 330: 1304-1305, 2005)。
メトホルミンが糖尿病患者の膵がんリスクを低下させることを示す結果が報告されています。糖尿病の患者でメトホルミンを服用していた場合、メトホルミンを服用しなかった人々と比べて、膵がんのリスクが 62 %低減することが示されています。一方、インスリンまたはインスリン分泌促進薬を使用した糖尿病患者では、それらを使用しなかった患者と比較して、それぞれ、膵がんのリスクが 4.99 倍と 2.52 倍に増加しました。(Gastroenterology 137:482-488, 2009)
台湾で実施された80万人を対象にした前向きコホート研究では、2型糖尿病があって血糖降下剤を服用していないグループでは、大腸がん・肝臓がん・胃がん・膵臓がんの発生率が約2倍に高く、メトホルミンの服用によって非糖尿病グループのレベルに低下することが報告されています。この論文では、1日500mgのメトホルミンががん(特に、胃がん、結腸直腸がん、肝臓がん、膵臓がん)の発生率を著明に低下させるという結論が記述されています。(BMC Cancer 2011 Jan 18: 11(1):20)
その後も、多くのがんで、メトホルミンのがん予防効果や抗がん作用が報告されており、最近では、非糖尿病のがん患者に対してメトホルミンの抗がん作用が検討されています。 メトホルミンががん細胞やがん幹細胞の抗がん剤感受性を高める作用、転移を抑制する作用などが数多く報告されています。抗がん剤や放射線治療中にメトホルミンを同時に服用すると、腫瘍縮小効果が高まることが乳がんや食道がんや大腸がんなど多くのがんで確認されています。
メトホルミンはインスリン感受性を高めて、少ないインスリン分泌で血糖のコントロールを可能にする薬なので、インスリン分泌を刺激する糖尿病治療薬と異なり、糖尿病がない人が服用しても低血糖にはなりにくい薬です。そのため、米国などでは非糖尿病のがん患者に1日1500mg前後のメトホルミン投与で抗腫瘍作用が検討されています。最近の報告として以下のような論文があります。
Metformin: A Potential Therapeutic Agent for Recurrent Colon Cancer(メトホルミン:再発性大腸がんに対する潜在的な治療薬)PLoS One. 2014; 9(1): e84369.
【要旨】 ビグアナイド系の糖尿病治療薬のメトホルミンが抗がん作用を有することを示すエビデンスが集まっている。しかし、メトホルミンの抗がん作用に関する研究の多くは原発がんを対象にしたものである。 メトホルミンが再発がんに対しても有効な抗腫瘍効果を示すかどうかを検討した報告はまだ無い。特に、50%以上の患者が標準的な抗がん剤治療を受けている結腸直腸がんの再発に対する効果を知ることは有用である。
がんの再発のメカニズムは十分に解明されているわけではないが、抗がん剤に抵抗性のがん幹細胞が治療に対して抵抗性で生き残るためと考えられている。 したがって、がん幹細胞をターゲットにした毒性の少ない治療戦略の開発は、再発大腸がんの治療効果を高める上で極めて重要である。
この研究では、抗がん剤抵抗性のがん幹細胞に対する5-フルオロウラシル(5-FU)とオキサリプラチンの併用治療にさらにメトホルミンを追加した場合の有効性について検討した。
実験結果は、メトホルミンが 5-FUとオキサリプラチンの抗腫瘍効果に相乗的に作用して、抗がん剤抵抗性の大腸がん細胞株(HT-29とHCT-116)に細胞死を誘導し、がん幹細胞の増殖による細胞塊の形成を阻害した。 培養細胞を使用した実験では、5-FUとオキサリプラチンとメトホルミンの併用は抗がん剤抵抗性の大腸がん細胞の移動を阻害した。 この変化はマイクロRNA 145(miRNA 145)の増加とマイクロRNA 21(miRNA21)の増加と関連していた。また、大腸がんの増殖を促進するWnt/βカテニン・シグナル伝達系は抑制されていた。
抗がん剤抵抗性の大腸がん細胞(HCT-116とHT-29)を免疫不全マウスに移植した移植腫瘍の動物実験モデルでの検討では、5-FUとオキサリプラチンにメトホルミンを併用することによって移植腫瘍の増殖速度を顕著に抑制できた。
我々の実験結果は、再発した抗がん剤抵抗性の大腸がんに対して、標準的な抗がん剤治療にメトホルミンを併用することが有効であることを示唆している。Metformin enhances tamoxifen-mediated tumor growth inhibition in ER-positive breast carcinoma(エストロゲン受容体陽性の乳がん細部に対するタモキシフェンの増殖抑制作用をメトホルミンは増強する)BMC Cancer. 2014; 14: 172.
【要旨】
背景:乳がんのホルモン療法で使用されるタモキシフェンはエストロゲンとエストロゲン受容体(ER)の結合を阻害して増殖抑制効果を発揮する。しかしながら、ER陽性乳がんの多くの患者はタモキシフェンによる抗腫瘍効果が弱かったり、あまり効果が出ない場合もある。メトホルミンは糖尿病治療薬として広く使用され、抗がん作用があることが報告されている。この研究では、ER陽性の乳がんのタモキシフェン治療にメトホルミンを併用することによって抗腫瘍効果の増強作用があるかどうかを検討した。
方法:ER陽性乳がん細胞に対するメトホルミン単独およびメトホルミンとタモキシフェンの併用の場合の作用を、細胞生存、DNA合成活性、コロニー形成能、フローサイトメトリー、免疫染色、ヌードマウスへの移植腫瘍を使った実験モデルで検討した。
結果:タモキシフェンとメトホルミンを併用すると、乳がん細胞の増殖抑制に必要なタモキシフェン濃度は著明に減少した。 さらに、タモキシフェンによる乳がん細胞の増殖、DNA合成活性、コロニー形成能、軟寒天コロニー形成能の阻害作用をメトホルミンは増強し、タモキシフェンによるアポトーシス誘導作用を亢進した。この作用は、bax/bcl-2アポトーシス・シグナル伝達系とAMPK/mTOR/p70S6細胞増殖シグナル伝達系が関与していた。さらに、移植腫瘍を用いた動物実験で、タモキシフェンとメトホルミンの併用は腫瘍の成長を顕著に抑制した。
結論:メトホルミンとタモキシフェンの併用はER陽性乳がん細胞の増殖を相加的に阻害し、アポトーシス誘導を増強した。ER陽性乳がんの治療にメトホルミンとタモキシフェンの併用は抗腫瘍効果の増強が期待できるので、さらに臨床例での検討が必要である。Antidiabetic Drug Metformin Prevents Progression of Pancreatic Cancer by Targeting in Part Cancer Stem Cells and mTOR Signaling. (抗糖尿病薬のメトホルミンはがん幹細胞とmTORシグナルを介して膵臓がん細胞の進展を阻害する)Transl Oncol. Dec 2013; 6(6): 649–659.
【要旨】
多くの疫学データは糖尿病が膵臓がんの発生リスクを高めることを明らかにしている。そして近年のメタ解析によって、糖尿病治療薬のメトホルミンが膵臓がんの発生リスクを減らすことが明らかになっている。 膵臓がんを発生するように遺伝子改変したトランスジェニックマウスを用い、膵臓がん発生過程に対するメトホルミンの効果を検討した。
コントロール食を投与されたマウスの膵臓がん発生率はオスが80%でメスが62%であった。 メトホルミンを1000ppmで投与すると膵臓がんの発生率はオスで20%、メスで7%であり、2000ppmのメトホルミン投与量の場合の膵臓がん発生率はオスで26%でメスで0%であった。 1000~2000ppmのメトホルミンの投与で発生した膵臓がんの重要はコントロール群の34~49%をしめした。 メトホルミン投与は早期膵臓がん病変(上皮内がん)の発生を28から39%抑制し、膵臓がん細胞の広がりを顕著に抑制した。
メトホルミンを投与されたマウスの膵臓組織および血清のmTOR(哺乳類ラパマイシン標的タンパク質)、ERK(extracellular signal-regulated kinases)、リン酸化されたpErk(extracellular signal-regulated kinases)、インスリン様成長因子-1、などの低下を認めた。膵臓組織におけるがん幹細胞のマーカーの発現は顕著に低下していた。
以上の結果より、メトホルミンはがん幹細胞を減らし、mTORシグナル伝達系を抑制する作用があることが示唆された。この前臨床試験の結果は、膵臓がんの化学予防の臨床試験にメトホルミンを検証する価値があることを意味している。Metformin intake associates with better survival in ovarian cancer: A case control study(メトホルミン摂取は卵巣がんの生存率を高める:ケースコンロトール研究)Cancer. Feb 1, 2013; 119(3): 555–562.
【要旨】
背景:卵巣がん患者の生存とメトホルミン摂取の関連を検討する目的で研究を行った。
方法:この後ろ向きケースコントロール試験(症例対照試験)ではメトホルミンを服用している卵巣がん患者と、ステージや年齢などの条件を合わせたコントロール(メトホルミンを服用していない卵巣がん患者)を比較した。
結果:メトホルミンを服用していた卵巣がん患者72例と対照143例の予備試験の解析では、5年生存率はメトホルミン服用群が73%に対して対照群は44%で、統計的に有意な差を認めた(p=0.0002)。
メトホルミン服用群61例、(全ての条件を症例群に合わせた選択した)対照群178例の解析では、5年生存率はメトホルミン服用群で67%、対照群で47%であり、統計的に有意な差を認めた(p=0.007)。
結論:メトホルミンの服用は卵巣がん患者の生存率を高める。したがって、卵巣がん患者における臨床試験を実施する価値がある。以上のように、まだ基礎研究の段階の報告が多いのですが、非糖尿病患者を対象にした臨床試験も行われており、がん幹細胞の抗がん剤感受性を高める作用などが報告されています。
非糖尿病患者でも、大腸がんや乳がんや膵臓がんや卵巣がんなど多くのがんの治療にメトホルミンを1日500~1500mg程度併用することは有用と考えられます。メトホルミンに加えて、ラパマイシンと2-デオキシ-D-グルコースを併用すると抗腫瘍効果を高めることができます。(詳しくはこちらへ)
低用量ナルトレキソン療法(1ヶ月分が9000円)やオピオイド増殖因子の点滴(週1回、1回25000円)を併用すると抗腫瘍効果を高めることができます。(低用量ナルトレキソン療法とオピオイド増殖因子についてはこちらへ)がん細胞の解糖系とmTORC1をターゲットにしたがん治療としてメトホルミンとラパマイシンと2-デオキシ-D-グルコースの組合せに糖質制限あるいはケトン食の併用は理論的には抗腫瘍効果を期待できます(下図)。実際に進行がんで複数の有効例を経験しています。
がん細胞のエネルギー産生系(解糖系と酸化的リン酸化)とmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)をターゲットにすると、がん細胞の増殖を抑制できると同時に正常細胞の老化を抑制し寿命を延ばす可能性が老化研究から示唆されている。老化研究で寿命を延ばす作用が検討されてるラパマイシン、メトホルミン、2-デオキシ-D-グルコース(2-DG)、カロリー制限、糖質制限、ケトン食の組合せは、がんと共存しながら寿命を延ばす治療法といえる。