寿命を延ばすがん治療:2-デオキシ-D-グルコース+メトホルミン+ラパマイシン+ケトン食
【老化とがん化には共通点が多い】
分子標的薬の中にはがん細胞の増殖と同時に老化の進行を遅らせる作用をもったものがあります。その理由は、がん治療のターゲットになっているシグナル伝達系と老化に関連する因子に共通のものが多くあるからです。
老化の研究者はがん治療で開発された分子標的薬は抗老化治療の宝庫だと言っています。つまり、老化予防や寿命延長の効果を持ったがん治療が可能ということです。
正常細胞に様々なダメージを与える通常の抗がん剤治療は老化や寿命に対してマイナスに作用しますが、老化や寿命に対してプラスの作用をもつ抗がん剤で治療すれば、それは理想のがん治療になります。
老化を遅らせ寿命を延ばす最も確実な方法はカロリー制限です。カロリー制限とは、栄養障害を起こさずに食事からの摂取カロリーを30~40%程度減らす食事を行うことで、カロリー制限には老化を遅延して寿命を延ばし、老化関連疾患の発症を遅らせる効果が認められています。カロリー制限ががんの発生を抑制することも明らかになっています。
このカロリー制限による老化遅延や寿命延長やがん抑制のメカニズムには長寿遺伝子と言われるサーチュインなど様々な因子の関与が指摘されていますが、その因子の中に、インスリン、インスリン様成長因子-1(IGF-1)、PI3K/Aktシグナル伝達系、mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)、AMP活性化プロテインキナーゼ(AMPK)、転写因子のFOXO(Forkhead box O)などがあり、これらはがんの予防や治療における重要なターゲットになっています。
例えば、カロリー制限はATPの量を減らすことによってAMPKを活性化します。インスリン/IGF-1シグナル伝達系で活性化されるPI3K/Ak/mTORC1は老化を促進しがん細胞の増殖を促進します。AMPKはこのシグナル伝達系を抑制します。
ネズミに30~40%のカロリー制限を行うとIGF-1濃度が30~40%減少し、がんの発生率が低下し、寿命が延びるという結果が報告されています。 線虫の研究では、カロリーを制限しなくても、カロリー摂取で応答するインスリンの信号伝達系に欠陥がある変異体は普通にエサを食べていても長生きすることが明らかになっています。
細胞には古くなったタンパク質を分解してリサイクルするオートファジー(自食作用)というメカニズムがあります。飢餓状態になったときに自分の細胞を分解して栄養源にするのが本来の目的ですが、細胞内の老化したタンパク質を除去する作用もあります。
一時的飢餓あるいは軽度の飢餓はオートファジー亢進を通じて細胞内をきれいにして、細胞を若返らせる効果があり、さらにがんを予防することもできます。オートファジーの抑制は細胞内に異常タンパク質や不良ミトコンドリアが蓄積することが引き金になって細胞のがん化が促進されるからです。
カロリー制限は完全な絶食ではなく、普通の食事の60%程度のカロリーに抑えるのですが、この程度の弱い飢餓でもオートファジーが誘導されます。 インスリンやインスリン様成長因子-1(IGF-1)によって活性化されるmTORC1はオートファジーを抑制することによって細胞の老化とがん化を促進する作用が指摘されています。
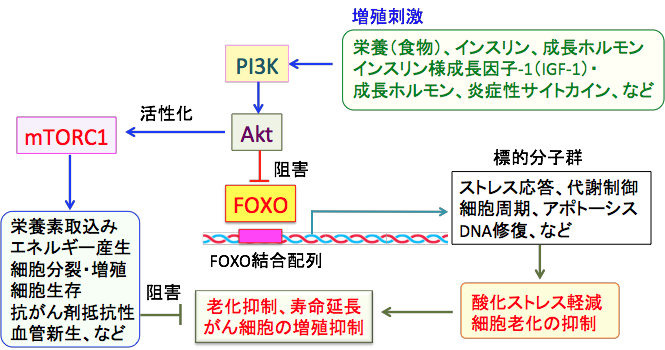
FOXOは「Forkhead box O」の略で、DNA結合ドメインFOX(Forkhead box)をもつForkheadファミリーのサブグループ“O”に属する転写因子で、栄養飢餓時に活性化されます。 FOXOはインスリン-PI3K-AKTシグナルによって負に制御されています。つまり、PI3K-AKTシグナルが活性化されるとAKTによって直接的にリン酸化され、FOXOの核外移行を促進することでその転写活性は抑制されます。一方、栄養飢餓状態ではPI3K-AKTの不活性化に伴いFOXOの活性化が誘導されることになります。つまり、FOXOはカロリー制限による寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています(下図)。
様々な増殖刺激によってPI3k/Aktシグナル伝達系が活性化されるとFOXO(Forkhead box O)という転写因子の活性が抑制される。FOXO転写因子が活性化されると酸化ストレスが軽減し、細胞老化が抑制される。Aktの活性化はmTORC1を活性化してがん細胞の増殖を促進する。したがって、PI3k/Aktシグナル伝達系を抑制すると、FOXO転写因子の活性化とmTORC1の抑制の2つの機序で寿命延長とがん抑制の効果が得られることになる。
以上のように、インスリン/IGF-1シグナル伝達系で活性化されるPI3K/Ak/mTORC1シグナル伝達系を抑制し、AMPKやFOXOの活性化は、がん細胞の発生や増殖を抑制する作用があり、しかも老化を抑制し寿命を延ばす作用があります。したがって、これらをターゲットにしたがん治療は副作用のない理想的ながん治療法なり得ると言えます。
がん治療で開発された分子標的薬が抗老化治療薬の候補として研究されています。がんの場合は、そのシグナル伝達系に次々に変異や異常が発生してくるので、治療に抵抗性になってくる可能性があります。しかし老化予防の目的ではそのような耐性はできないので、これらのがん治療薬をそのまま抗老化薬に使用すると有効性が維持できるというメリットがあると考えられています。
このような薬を低用量で服用すると老化を遅延させ寿命を延ばせると考えられています。薬による寿命延長は線虫やショウジョウバエやマウスなどでは実証されています。霊長類ではカロリー制限による老化遅延と寿命延長は実証されていますが、薬での実験はまだ出ていません。
老化予防は究極のがん予防法と言われています。つまり、がんは老化性疾患の一つであり、老化の過程を抑制することはがんの発生を予防することになります。このような薬ががん予防薬(循環器疾患の予防や寿命延長にも効果がある)として期待されています。
がんになって寿命を延ばすためには、がんと老化の両方に関与しているシグナル伝達系や因子をターゲットにすればよいといえます。
【カロリー制限と類似の作用を示す2-デオキシ-D-グルコース】
カロリー制限による寿命延長の研究を行っている米国国立老化研究所(National Institute on Aging)のジョージ・ロス(George Roth)博士の研究グループは、カロリー制限と同じ効果を真似る薬の開発において、2-デオキシ-D-グルコース(2-Deoxy-D-glucose:以下2-DG)の可能性を研究していました。カロリー制限と同じ効果(抗老化や寿命延長効果)を示す薬をCalorie restriction mimetics (CRM:カロリー制限模倣化合物)と言います。 CRMには抗糖尿病薬のメトホルミン、赤ワインに含まれるレスベラトロール、ポリアミンの一種のスペルミジンなども知られていますが、2-DGはCRMとして最初に研究された物質です。現在でも抗老化の観点からの研究が行われています。
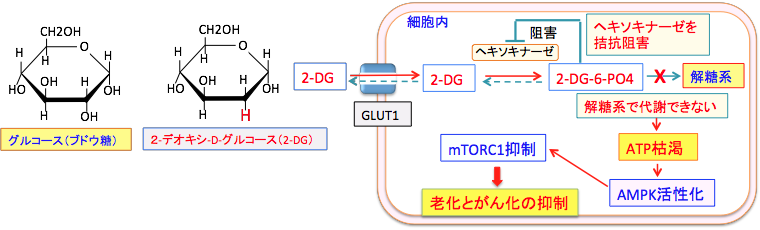
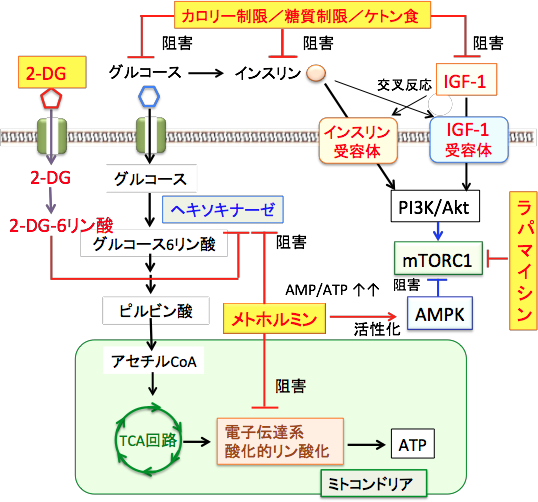
2-DGは、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換された物質(グルコース誘導体)です。 2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター:GLUT)を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。 リン酸化されて2-DG-6リン酸になるとGLUTを通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内で蓄積します。 蓄積した2-DG-6リン酸はヘキソキナーゼをフィードバック阻害するので、正常のグルコースの代謝も阻害されます。グルコース代謝が阻害されてATP量が減少するとAMP活性化プロテイン・キナーゼ(AMPK)が活性化され、活性化されたAMPK はmTORC1(哺乳類ラパマイシン標的タンパク質)を抑制します。mTORC1は老化と発がん過程の両方を促進する働きがあるので、mTORC1の抑制は抗老化と抗がんの両方の効果になります。(下図) 。
2-デオキシ-D-グルコース(2-DG)はグルコースと同様に細胞内に取り込まれ、ヘキソキナーゼで2-DG-6-リン酸(2-DG-6-PO4)に変換されるが、それから先の解糖系酵素で代謝できないので、2-DG-6-PO4でストップしてATP産生ができない。蓄積した2-DG-6-PO4はヘキソキナーゼをフィードバック阻害するので、正常なグルコースの解糖系での代謝も阻害される。その結果、細胞内のATPが減少し、AMP活性化プロテイン・キナーゼ(AMPK)が活性化される。活性化したAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質)を抑制するので、細胞の老化とがん化を抑制することになる。
普通に食事を摂取しても2-DGによってグルコースの代謝を抑制すれば、たくさん食べても太らずにすむし、カロリー制限と同じメカニズムで老化予防に有効ではないかというのが、2-DGの抗老化作用のメカニズムです。
線虫の実験では、2-DGが寿命を顕著に延長する結果が得られています。 しかし、ラットの実験では2-DGを大量に長期間投与すると心筋細胞の空砲化と死亡率の上昇などの毒性が確認されています。(Toxicol Appl Pharmacol 243(3): 332-9, 2010年) つまり、動物にとっては老化予防や寿命延長の目的では2−DGは現実的とは言えないようです。 ただし、てんかんやがんの治療目的においては、臨床効果の方が毒性より上回っていると考えられ、人間での臨床試験が行われています。
また、適量を使用すれば、毒性が出ずに抗老化作用や健康作用が期待できる可能性は残されています。最近も2-DGの抗老化作用に関する研究は幾つも報告されています。 例えば、2-デオキシ-D-グルコースがケトン体の産生を高めて神経細胞におけるミトコンドリアでのエネルギー産生を高めることによってアルツハイマー病を改善する作用が動物実験で確認されています。(PLos ONE 6(7): e21788, 2011年)
アルツハイマー病が発症する前に神経細胞のミトコンドリアでのエネルギー産生が低下することが報告されており、2-DGはケトン体の産生を増やすことが知られています。この論文では、マウスのアルツハイマー病の実験モデルに2-DGを投与すると、神経細胞のミトコンドリアでのエネルギー産生が増え、ベータアミロイドの沈着などアルツハイマー病の病変が軽減することが報告されています。カロリー制限やケトン食がアルツハイマー病の治療に有効であることは多くの研究で指示されています。2-DGはカロリー制限と同様な作用を示し、ケトン体の産生を増やす点で抗老化作用が期待されています。 このように解糖系でのグルコースの代謝を2−DGで抑制するとカロリー制限と同じように抗老化作用が期待できます。さらに、2-DGはがん細胞の増殖を抑制する作用があります。
【グルコースの取込みが多いがん細胞は増殖活性が高い】
一般的にグルコースの取込みの多いがん細胞ほど増殖が早く、悪性度が高く、予後が悪いと言えます。取り込まれたグルコースがエネルギー産生と細胞を構成する成分の合成に使われるからで、グルコースの取込みが多いことは増殖活性が高いことを意味します。 したがって、がん細胞におけるグルコースの取込みや解糖系での代謝を阻害すると、がん細胞の増殖活性を低下させることができます。
また、抗がん剤治療や放射線治療にグルコースの取込みや解糖系を阻害する治療を併用すると、抗がん剤や放射線治療の効き目を高めることができます。 がん細胞が抗がん剤や放射線でダメージを受けても、エネルギー(=ATP)と細胞成分を作る材料、すなわちグルコースが十分に供給されておれば、ダメージを修復して増殖を続けることができます。しかし、がん細胞におけるグルコースの取込みや利用を阻害すれば、ダメージを修復することができません。
グルコースの取込みやエネルギー産生過程を阻害する方法は、抗がん剤や放射線に対するがん細胞の感受性を高める効果が期待でき、がん治療の重要なターゲットになっています。(下図)
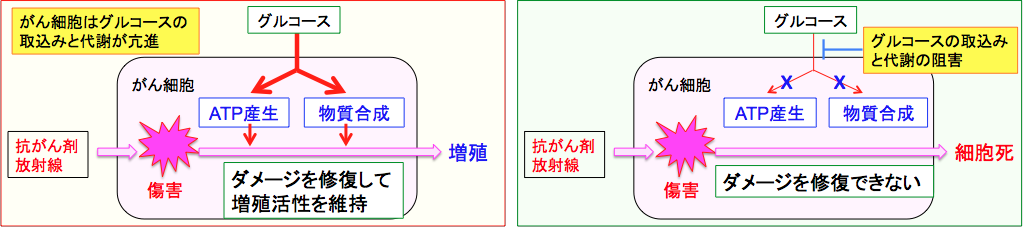
(左)がん細胞はグルコーストランスポーター1(GLUT1)の発現量が多く、グルコースの取込みと代謝(解糖系とペントース・リン酸経路)が亢進してATP産生と細胞を構成する物質(細胞膜や核酸など)の合成が亢進している。抗がん剤や放射線照射によって細胞がダメージを受けても、グルコースの取込みと代謝の亢進によって、ダメージを修復して増殖活性を維持できる。
(右)グルコースの取込みや代謝が阻害されると、ダメージの修復に必要なATPも物質合成も行えなくなる。そうなると抗がん剤や放射線で受けたダメージを修復できないので、細胞死をきたすことになる。。
【2-DGで解糖系を阻害するとがん細胞は死滅する】
2-DGはグルコース(ブドウ糖)と同じグルコース輸送担体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれ、解糖系の最初のステップのヘキソキナーゼによって2-DG-6リン酸に変換されます。 リン酸化されて2-DG-6リン酸になるとGLUT1を通過できなくなり、2-DG-6リン酸はその次の解糖系酵素では代謝できないため細胞内でどんどん蓄積します。
がん細胞内に蓄積した2-DG-6リン酸はヘキソキナーゼを阻害するので、通常のグルコースの代謝も阻害されます。 2-DGを取り込んでエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーター(GLUT1)の発現がさらに増え、2-DGの取り込みをさらに増やすことになります。 したがって、がん細胞には正常細胞に比べてより多くの2-DGが取込まれ、エネルギー産生と物質合成の阻害による影響はがん細胞で大きくなります。 つまり、糖質制限やケトン食のときに2-DGを併用すると、2-DGが優先的にがん細胞に取り込まれ、解糖系やペントース・リン酸経路を阻害して、がん細胞を内部から崩壊させることができるのです。
2-DGががん細胞の増殖を抑制する効果が指摘されたのは1950年代です。「細胞のエネルギー源であるグルコースの誘導体を取り込ませれば、がん細胞の増殖を抑制できる」というアイデアは、もう60年も前に研究されており、グルコースの誘導体の抗腫瘍活性が検討され、2-DGに強い抗腫瘍効果があることが証明されています。 しかし、2-DGを使ったがん治療は、その後あまり注目されなかったようです。その理由の一つは、がんの治療においては、「強い毒性をもった化合物を使ってがん細胞を一掃するような治療法」が1950年代以降は主流になっていたからだと思われます。 そのため、「エネルギー産生経路を阻害してがん細胞の増殖を低下させる」というようなアイデアは注目されなかったのかもしれません。
しかし、がん細胞のエネルギー産生の特徴であるワールブルグ効果が再評価されるようになり、がん細胞のエネルギー産生と物質合成を阻害する方法として、2-DGにも注目が集まるようになり、多くの動物実験で抗腫瘍効果が証明され、人間での臨床試験も実施されるようになったということです。
【2-DGは正常細胞を抗がん剤や放射線のダメージから保護する】
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害するので、がん細胞の増殖速度を低下させる効果があります。がん細胞のエネルギー産生や物質合成の経路を阻害すると、抗がん剤や放射線に対するがん細胞の感受性が高まります。 2-デオキシ-D-グルコース(2-DG)は抗がん剤や放射線に対するがん細胞の感受性を高めるだけでなく、抗がん剤や放射線による正常細胞のダメージを軽減する効果があるという報告があります。
がん細胞は正常細胞に比べてグルコース(ブドウ糖)の取込みが多く、ATP産生や細胞分裂するための物質合成に大量のグルコースを必要としています。したがって、グルコースの取込みや利用を妨げれば、ATP産生や物質合成が低下し、抗がん剤や放射線治療の効き目が高くなります。 がん細胞はグルコーストランスポーターを多く発現しているので、2-DGの取込みも多く、2-DGによるグルコース代謝の阻害作用が著明に現れます。培養細胞を使った実験や動物にがん細胞を移植した動物実験で、2-DGを投与すると抗がん剤や放射線治療の治療効果が高まることが多くの実験系で確認されています。
さらに動物実験で、2-DGが脳や心臓に対する抗がん剤や放射線のダメージを軽減する作用が認められています。その作用機序についてはまだ十分に解明されていませんが、AMP活性化プロテインキナーゼ(AMPK)の活性化など複数のメカニズムが示唆されています。
このように、2-DGはがん細胞の抗がん剤感受性や放射線感受性を高め、正常細胞に対しては抗がん剤や放射線のダメージから守る作用があります。 また、抗がん剤や放射線治療に2-DGを併用すると抗腫瘍免疫を誘導できることが報告されています。 がんや感染症に対する免疫応答で重要な記憶キラーT細胞(memory CD8+T cell)の働きを高めるという報告もあります。
以上のように、2-DGは様々なメカニズムで抗腫瘍作用を示し、特に抗がん剤や放射線治療との併用で、抗腫瘍効果を高めるだけでなく、正常細胞を保護する作用もあるので、がん治療の補完として利用価値は高いと言えます。適切な量を使用すれば抗老化にも有効かもしれません。
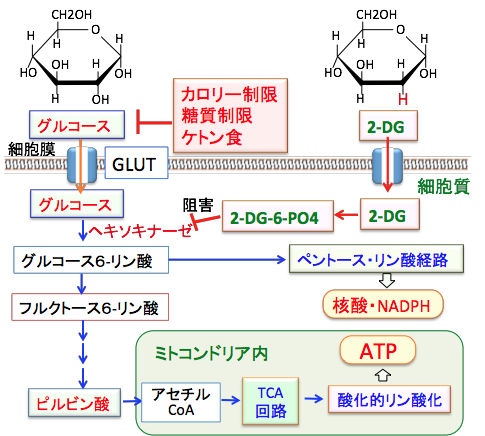
2−デオキシ-D-グルコース(2-DG)はグルコースと同じようにグルコーストランスポーター(GLUT)を通って細胞内に入る。グルコースはヘキソキナーゼでグルコース-6-リン酸に変換されてさらに解糖系酵素で分解されてATP産生へ使われ、ペントースリン酸回路で核酸やNADPHの合成に利用される。2−DGはヘキソキナーゼで2-デオキシ-D-グルコース-6-リン酸(2-DG-6-PO4)に変換されるが、2-DG-6-PO4はその先の解糖系酵素で代謝できない。細胞質内で蓄積した2-DG-6-PO4はヘキソキナーゼをフィードバック阻害するので、解糖系でのグルコース代謝が阻害されてATP産生や核酸やNADPHの産生が低下する。
【寿命延長効果と抗がん作用を持つラパマイシン】
ラパマイシン(Rapamycin)という薬があります。シロリムス(Sirolimus)という別名で呼ばれることもあります。これは臓器移植の際の拒絶反応を防ぐために使用される薬ですが、このラパマイシンに寿命延長効果と抗がん作用が明らかになったことから、ラパマイシンの生体内のターゲット分子である哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)という蛋白質が注目されています。
ラパマイシンは1970年代にイースター島(モアイ像で有名な南太平洋の島)の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生する有機化合物です。イースター島はポリネシア語で「ラパ・ヌイ(Rapa Nui)」と言い、この「ラパ」と「菌類が合成する抗生物質」を意味する接尾語の「マイシン」とを組み合わせて「ラパマイシン」と名付けられています。
ラパマイシンの薬効としては、臓器移植の拒絶反応を防ぐ作用の他に、抗がん作用や寿命延長効果が知られています。寿命延長作用については、生後600日のマウス(人間では60歳ほどに相当)にラパマイシンを投与すると、通常に比べてメスは平均で13%、オスは9%長生きしたという動物実験の結果が報告されています。
寿命を延ばす方法として現時点で最も確実なのがカロリー制限です。カロリー制限とは、栄養障害(ビタミンやミネラルやタンパク質の不足)を起こさずに食事からの摂取カロリーを30~40%程度減らす食事を行うことで、カロリー制限には老化を遅延して寿命を延ばし、がんを含めて老化関連疾患の発症を抑制する効果が認められています。
このカロリー制限による老化過程の遅延と寿命延長とがん抑制に最も重要な因子がmTORです。 ラパマイシン自体に抗がん作用が報告されていますが、ラパマイシンの構造を改変した物質(ラパマイシン誘導体)が抗がん剤として開発されて、すでに幾つかの薬が臨床で使用されています。
このようなラパマイシンの多彩な薬効は、細胞の増殖やエネルギー産生に重要な役割を担っている細胞内蛋白質に作用することによって発揮されますが、このラパマイシンがターゲットにする蛋白質がmTORという蛋白質なのです。。
【寿命延長効果と抗がん作用を持つラパマイシン】
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼ(タンパク質のセリンやスレオニンをリン酸化する酵素)で、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。 初め、酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(哺乳類ラパマイシン標的タンパク質)と命名されました。
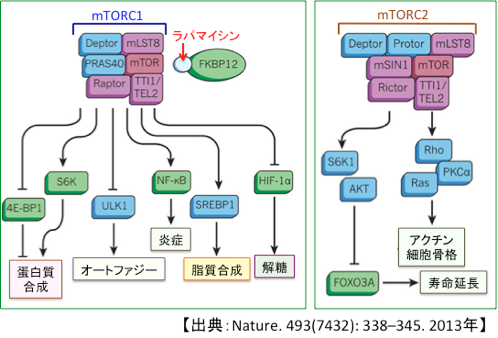
mTORにはmTOR複合体1((mammalian target of rapamycin complex 1:mTORC1)とmTOR複合体2(mammalian target of rapamycin complex 2:mTOR2)の2種類があります。mTORに幾つかの他のタンパク質が結合して複合体を形成しますが、結合しているタンパク質の違いで2種類の複合体ができ、異なる機能を担っています。(下図)
mTOR(哺乳類ラパマイシン標的タンパク質)は2種類の複合体(mTORC1とmTORC2)として存在する。mTORC1とmTORC2はそれぞれ異なる蛋白質と複合体を形成し、それぞれ異なる機能をもつ。ここに記載されているエフェクタータンパク質は一部であり、もっと多くのタンパク質が関与している。まだ十分に解明されていない部分も多い。 例えば、mTORC1はタンパク質翻訳を抑制する4E-BPをリン酸化してその機能を抑制する。また、リボソームの生合成を促進するS6Kをリン酸化して活性化する。これらの作用によってmTORC1は蛋白質合成を促進する。その他、多くの標的タンパク質をリン酸化することによって細胞内のタンパク質合成を促進することによって細胞の増殖や物質代謝を制御する。また、細胞内小器官の消化・再利用に重要なオートファジーを抑制する作用や、低酸素誘導因子-1(HIF-1)を活性化して解糖系を亢進する作用、脂質合成を亢進する作用などもある。 このように、mTORC1は栄養素の供給状況や増殖刺激や細胞内のエネルギーの状況などに対するセンサーとして作用し、細胞内の物質代謝やエネルギー産生を調節する中心的な役割を担っている。一方、mTORC2は細胞骨格やシグナル伝達の制御などに関与している。mTORC2はS6K1とAKTの活性化を介して、細胞の寿命を延長するFOXO3aを抑制する作用がある。ラパマイシンはFKBP12と結合し、mTORとraptorの相互作用を阻害することによってmTORC1の活性を阻害する
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。インスリンやインスリン様成長因子やロイシンによって活性化されるのはmTORC1の方です。ラパマイシンで阻害されるのもmTORC1の方です。
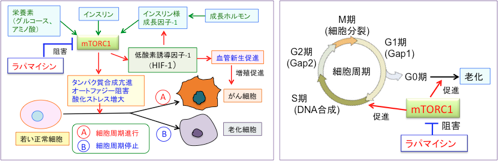
mTORC1は、糖やアミノ酸などの栄養素の状況、エネルギー状態、成長因子(増殖因子)などによる情報を統合し、エネルギー産生や細胞分裂や生存などを調節しています。 細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスのことです。したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を分解して得られるATP)が必要です。増殖因子や成長因子やホルモンなどによって細胞増殖の指令(シグナル)が来たときに、栄養素とエネルギーの供給が十分にあることを判断し、タンパク質や脂質の合成を促進して細胞増殖を実行するスイッチを入れるのがmTORC1です。
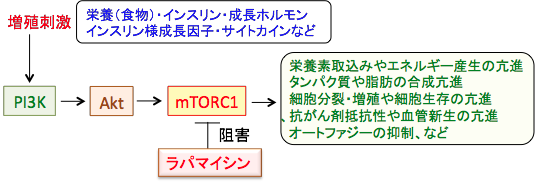
栄養摂取やインスリン、成長ホルモン、IGF-1、サイトカインなどの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。このAktのターゲットの一つがmTORC1というわけです。 Aktによってリン酸化(活性化)されたmTORC1は細胞分裂や細胞死や血管新生やエネルギー産生などに作用してがん細胞の増殖を促進します(下図)。
栄養摂取やインスリン、インスリン様成長因子-1(IGF-1)、サイトカインなどの増殖刺激が細胞に作用すると、PI3Kが活性化され、その下流に位置するAktの活性化、mTORC1の活性化と増殖シグナルが伝達される。mTORC1は栄養素の取込みやエネルギー産生、細胞分裂・増殖、細胞生存、抗がん剤抵抗性、血管新生を亢進し、オートファジー(自食作用)を抑制するので、mTORC1の活性化はがん細胞の発生や増殖や転移を促進する方向で働く。ラパマイシンはmTORC1の活性を直接阻害することによって抗がん作用を発揮する
この経路をPI3K/Akt/mTORC1経路と言い、がん細胞や肉腫細胞の増殖を促進するメカニズムとして極めて重要であることが知られています。すなわち、PI3K/Akt/mTORC1経路の阻害はがん細胞や肉腫細胞の増殖を抑制し、細胞死(アポトーシス)を誘導することができるため、がん治療のターゲットとして注目されています。
PI3K/Akt/mTORC1経路の阻害は、抗がん剤や放射線治療の効き目を高める効果や、血管新生を阻害することによってがん細胞の増殖を抑制する効果も報告されています。
低酸素誘導因子-1(HIF-1)はmTORC1によって活性化されるため、ラパマイシンはHIF-1の活性を阻害することによってがん細胞の代謝異常(解糖系亢進)を正常化する作用があります。 mTOR阻害剤は免疫抑制という欠点を持ちますが、がん細胞や肉腫細胞の多くにおいてmTORが活性化されているため、抗がん剤として有効性が高く、すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。(免疫に関しては単純な免疫抑制ではなく、記憶キラーT細胞の数を増やすなど抗腫瘍免疫にはプラスに働く面も報告されています。)
【がん細胞では細胞内シグナル伝達系に異常が多発している】
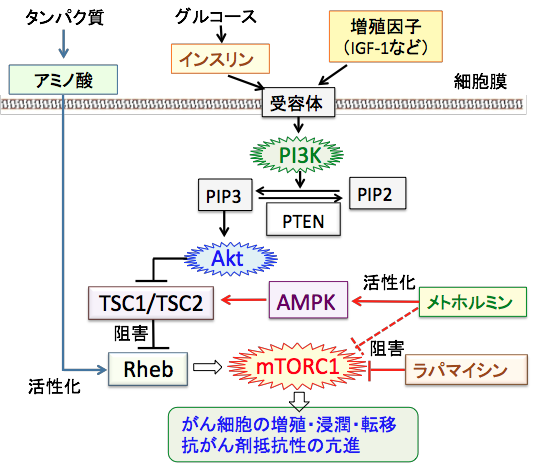
mTORC1の活性の制御には、多数の抑制因子(AMPKやTSC1/TSC2など)や促進因子(インスリン、インスリン様成長因子-1、Akt、アミノ酸など)が関わっています。 これらの制御系や細胞内のシグナル伝達系が正常に働いていれば、メトホルミンでAMPKを活性化すればmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)は抑制できます。 糖質摂取の制限やケトン食によってインスリン/インスリン様成長因子-1のシグナル伝達系を抑制してもmTORC1の抑制に効果があります。
しかし、がん細胞の場合は、このようなシグナル伝達系の上流で作用する薬を使っても必ずしもうまくいきません。それは、このシグナル伝達系の至るところで異常が起きているからです。 メトホルミンでAMPKを活性化しても、AMPKとmTORC1との間に存在するタンパク質(TSC1/TSC2やRheb)が異常を起こしていればmTORC1は抑制できません。インスリンの分泌を減らしても、PI3KやAktが遺伝子異常で恒常的に活性化しておればmTORC1の抑制はできません。
実際に、がん細胞ではAkt遺伝子の増幅(数が増えていること)や、PI3KやAktやmTORC1の活性を抑制するがん抑制遺伝子(PTENやTSC1/TSC2など)の遺伝子変異など、PI3K/Akt/mTORC1/HIF-1シグナル伝達系の至るところで異常が起こっていることが明らかになっています。
グルコースの取込みや解糖系の阻害は、エネルギー産生と物質合成を直接的に阻害するので、PI3K/Akt/mTOR/HIF-1シグナル伝達系の異常があっても効果は期待できますが、抗腫瘍効果は減弱します。 そこで遺伝子異常が高度に生じている進行がんの治療の場合は、mTORC1を直接阻害する薬が必要になります。メトホルミンやケトン食や解糖系の阻害(2-デオキシグルコースなど)でがん細胞の増殖が十分に抑制できない場合は、mTORC1に直接的に作用する薬(ラパマイシンやその誘導体)の併用が有効と言えます(図)。(メトホルミンはAMPKの活性化を介する機序以外に、mTORC1を直接阻害するという報告もある)
栄養摂取やインスリンやインスリン様成長因子-1(IGF-1)などの増殖刺激が細胞に作用するとPI3Kが活性化され、これがAktをリン酸化して活性化する。活性化したAktは細胞内のシグナル伝達に関与する様々な蛋白質の活性を制御することによって細胞の増殖や生存(死)の調節を行う。がん細胞では、PI3K/Akt/mTORC1シグナル伝達系に関与する様々なタンパク質の遺伝子変異などによってAktやmTORC1が恒常的に活性化しており、さらに、AMPKとmTORC1の間のシグナル伝達に関与するTSC1/TSC2やRhebに変異があるとメトホルミンでAMPKを活性化してもmTORC1を抑制できない。ラパマイシンやラパマイシン誘導体はmTORC1を直接阻害する。(メトホルミンはAMPKを介してmTORC1活性を抑制するルート以外に、mTORC1を直接阻害する作用があるという報告もある)
【mTOR阻害剤は老化性疾患の発生を遅らせ寿命を延長する】
マウスを使った実験では、mTORの活性を遺伝子改変や阻害剤(ラパマイシンなど)で抑制すると、老化関連疾患の発生が遅くなり、寿命が延びることが報告されています。例えば、遺伝子改変技術によってmTORタンパク質を生存に最低限必要な約25%しか生成できないマウスを作成したところ、寿命が正常マウスに比べて約20%延びることが報告されています。(Cell Rep. 4(5): 913–920. 2013)
また、mTOR阻害剤のラパマイシンがアルツハイマー病などの神経変性疾患を改善することが報告されています。知能機能低下をきたす遺伝性疾患では、mTOR活性が亢進しており、mTOR活性を低下させると知能が良くなることが多くの研究で明らかになっています。
がんも老化性疾患の代表と言えます。mTORの阻害剤ががんの発生を予防することは多くの研究で明らかになっています。 mTOR阻害は免疫細胞の働きを弱めるので、免疫力低下から感染症にかかりやすくなるデメリットがあるのですが、がん(悪性腫瘍)やアルツハイマー病や認知機能低下や心臓疾患や腎臓疾患などの老化性疾患に対して老化を抑制する方向で作用することが明らかになっています。 免疫系に対する作用の関しては、臓器移植の拒絶反応に使用されるように、一般的にはTリンパ球の働きを抑制するのですが、記憶CD8+T細胞を増やして抗腫瘍免疫にプラスに働く作用もあります。 mTORC1は膵臓のランゲルハンス島のβ細胞の量を増やし、インスリン分泌を促進する作用があるので、mTORC1の阻害はインスリンの分泌を減少させて2型糖尿病の発症を促進する可能性が指摘されています。しかし、糖尿病の合併症の微小血管病変(糖尿病性の網膜症や腎症や神経症)や大動脈の動脈硬化に対しては、mTORC1は低酸素誘導因子-1を活性化し血管内皮増殖因子(VEGF)を増やして血管新生を促進するので、これらの血管病変を悪化させます。したがって、糖尿病の合併症の抑制にラパマイシンが有効という報告はあります。
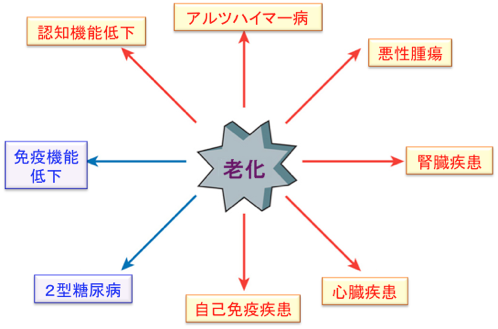
老化が関連する様々な疾患のうち、認知機能低下、アルツハイマー病、悪性腫瘍、腎臓疾患、心臓疾患、自己免疫疾患など多くの疾患に対してラパマイシンなどのmTORC1阻害剤は改善する方向で作用しますが、免疫機能低下と2型糖尿病に関しては、改善と悪化の両方の作用を示すようです。 免疫機能においてエフェクターT細胞の増殖を抑えますが、記憶キラーT細胞の数を増やす作用があります。糖尿病においては、微小血管障害などの合併症を抑制する効果が指摘されています(下図)。
老化性疾患に対するmTORC1の影響。
老化は様々な疾患の発症と進展の原因になるが、それらはmTORC1シグナル伝達系の影響を受けている。赤の矢印で示した疾患はラパマイシンで改善される。一方、青の矢印で示した疾患に関してはラパマイシンは促進と抑制の両方の作用を示す。
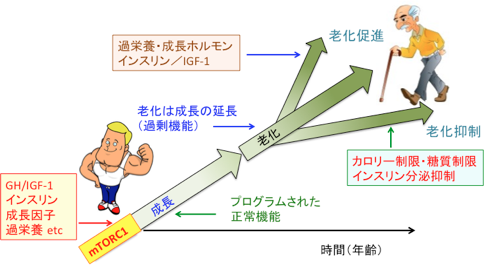
(出典:Nature. 493(7432): 338-345, 2013年)生まれてから生殖年齢に達するまで生き物は成長します。この成長過程において、成長ホルモンやインスリン、インスリン様成長因子、PI3K/AKT/mTORシグナル伝達系、性ホルモン、その他様々な成長因子などが重要な役割を果たしますが、特にmTORが細胞の増殖や成長の中心的役割を果たしています。 成長が終了したあとは、成長に関わってきた多くの因子が老化を促進し、がんの発生を促進する方向で作用します。つまり、老化は成長の延長であり、過剰機能と言えます(図)。
mTOR(哺乳類ラパマイシン標的タンパク質)は成長ホルモン(GH)やインスリン様成長因子-1(IGF-1)やインスリンや様々な成長因子や過剰な栄養によって活性化され、細胞の増殖や体の成長に中心的な役割を担っている。成長が終了したあともmTORC1の働きが過剰に続くと、細胞や組織の老化が促進される。成長終了後はmTORC1の活性は老化と発がんを促進する方向に作用する。
mTORC1は成長を促進しますが老化も促進します。したがって、成長が終了した段階でmTORC1を低下させるようにスイッチを切り替えるとその個体の寿命を延ばすことができます。 「老化は成長の延長」という生物の根本的な仕組みを利用すれば、自然の摂理に逆らって寿命を延ばすことができます。つまり、mTORC1自体あるいはmTORC1の活性化に関わる要因を減らせば、老化性疾患の予防と寿命の延長を達成できます。
成長が終了し生殖年齢に達したあとはmTORの活性を高めるようなことはがんの発生を促進し、寿命を短くすることになります。 つまり、体重や筋肉を増やすようなスポーツは老化や発がんを促進する可能性が高いといえるかもしれません。 牛乳タンパク質や糖質の多い食事も、mTORC1の活性を高めて老化を発がんを促進する可能性があります。 アンチエイジング(抗加齢)の治療では、年齢とともに低下した成長ホルモンや性ホルモンやインスリン様成長因子-1(IGF-1)を補って若返りをはかる方法が行われていますが、確かに短期的には体は若返りますが、長期的な寿命とがん発生リスクの上昇ということを犠牲にしている可能性があります。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)は細胞のがん化と老化の両方に関与している。栄養素(グルコースやアミノ酸など)、インスリン、インスリン様成長因子、その他の増殖因子はmTORC1シグナル伝達系を活性化し、細胞の成長や細胞周期(細胞分裂した細胞が再び分裂を起こすまでの過程)の進行を促進する。遺伝子変異などによって細胞周期の制御に異常が起こり、止めどなく細胞分裂を行うようになった細胞ががん細胞であり、細胞周期が進行しているがん細胞に対してはmTORC1の活性化は細胞増殖を促進することになる。一方、細胞が古くなってきて細胞周期が停止している細胞(G0期)にmTORC1活性が亢進すると細胞は老化した状態(完全に細胞増殖能を喪失し細胞機能も低下する)に移行する。ラパマイシンはmTORC1の活性を阻害することによって、細胞のがん化と老化の両方を抑制することができる。
【ラパマイシンの抗がん作用について】
mTORC1阻害剤でがん治療に使われているものとしてEvelorimus(商品名:アフィニトール)などがありますが、これはラパマイシン誘導体(Rapalogs)です。 ラパマイシンは元々は臓器移植の拒絶反応を予防する免疫抑制剤です。通常、免疫抑制剤はがんの発生率を高めるのですが、ラパマイシンは逆にがんの発生率を顕著に減少させる作用があることが明らかになりました。つまり、腎臓移植や肝臓移植を受けた患者さんを追跡調査するとラパマイシンを服用している患者さんはがんの発生率が極めて低いことが多くの研究で明らかになっています。
ラパマイシンの抗がん作用の研究は数多くあります。例えば、頭頚部扁平上皮がんや皮膚扁平上皮がんの治療や治療後の再発予防にラパマイシンが有効であることを示す報告が多数あります。
頭頚部の扁平上皮がんは6番目に多いがんで、世界中で1年間に50万人以上が発症し、米国だけで年間11000人がこの病気で死亡しているそうです。日本でも、肺がん、胃がん、大腸がん、肝臓がん、膵臓がん、乳がんなどに続いて6から7位くらいのようです。 日本の頭頸部癌の罹患率および死亡率は近年増加しています。頭頸部がんに関しては日本では年間約2万人が発症し、年間約9500人が死亡していると言われています。5年生存率は50%前後でこの30年間ほとんど改善はないということです。
このように治療成績が悪い理由の一つは、頭頚部は体の中でも特にリンパ管やリンパ節が多く存在し、リンパ節転移が起こりやすいためです。そして、診断時にリンパ節転移があると、再発しやすく予後は非常に悪くなります。 診断時に明らかなリンパ節転移の所見がなくても、10~50%の頻度で潜在的なリンパ節転移が存在すると考えられています。 そこで、頭頚部扁平上皮がんの生存率を良くするためには、リンパ節転移を抑制することが重要になります。 頭頚部扁平上皮がんの80%以上で、Akt/mTORシグナル伝達系の活性が亢進していると報告されています。
mTORは上皮細胞成長因子受容体の発現量と活性を高めます。mTORC1はリンパ脈管新生を促進し、リンパ節転移を増やす作用があります。したがって、ラパマイシンは扁平上皮がんの増殖や転移を抑制する効果が期待できます。
がん細胞ではがん抑制遺伝子のp53の変異が高頻度で起こっており、p53の変異があるがん細胞は治療に抵抗性を示します。ラパマイシンはp53の変異をもつがん細胞にも有効であることが報告されています。
多くの研究結果から、頭頚部の扁平上皮がんや皮膚がんの治療や、再発リスクの高い場合の再発予防にmTORC1阻害剤のラパマイシンを積極的に使用するメリットはありそうです。その他の多くの種類のがんについても、ラパマイシンが抗腫瘍効果を示すことが報告されています。
【他のがん治療との併用における安全性】
その作用機序から、ラパマイシンは抗がん剤治療や放射線治療の効き目を高める可能性が高いと言えます。その理由は、mTORC1を阻害すると、がん細胞は物質の同化が阻害されるので、ダメージを回復できないからです。 そこで、問題は、抗がん剤や放射線治療と併用した場合の安全性です。前述のように副作用が軽減する可能性が指摘されていますが、今まで行われている臨床試験の結果を調べておくことが必要です。
Phase I study of vinblastine and sirolimus in pediatric patients with recurrent or refractory solid tumors.(再発あるいは治療抵抗性の固形がんの小児患者におけるビンブラスチンとシロリムスの併用療法の第1相試験)Pediatr Blood Cancer. 61(1): 128-33, 2014年
シロリムス(Sirolimus)というのはラパマイシンの別名で同じ物質です。この臨床試験では再発性あるいは治療抵抗性の固形がん(脳腫瘍を含む)の患者14人(平均年齢8.7歳: 2.3歳から19歳)を対象にして、シロリムス(ラパマイシン)は血中濃度が10~15ng/mlになるように調整しながら経口投与で行い、ビンブラスチンとの併用を実施しています。 毒性はビンブラスチンの最高用量でグレード3の口腔粘膜炎が1例に認められました。骨髄抑制が最も頻度の高い副作用でした。1mgのラパマイシンの服用当たり血中濃度は約2ng/ml上昇しています。28日目には血中の可溶性血管内皮増殖因子受容体(sVEGFR2)が顕著に低下し、血管新生の阻害作用が認められています。
治療効果が検討できた11例のうち部分奏功が1例、3ヶ月以上の病状安定が3例に認められました。 この論文の結論は「mTOR阻害剤とビンクリスチンの併用療法は長期間の投与でも安全であり、血中を循環している血管新生を促進する因子(VEGFR2)を減らし、奏功率を高めた。」と言っています。A phase I study of decitabine and rapamycin in relapsed/refractory AML.(再発/治療抵抗性の急性骨髄性白血病に対するデシタビンとラパマイシンの併用療法の第1相試験)Leuk Res. 37(12): 1622-7, 2013年
この臨床試験では再発して治療抵抗性になった成人の急性骨髄性白血病患者12名を対象、メチル化阻害剤のデシタビンという抗がん剤を5日間投与(20mg/体表面積1平方メートル)し、その後20日間(day 6 to day 25)ラパマイシンを1日2mg,4mg, 6mgで投与しています。4例にグレード3の口腔粘膜炎を認めた以外には目立った副作用は認めなかったという結果が報告されています。
Clinical activity of mTOR inhibition in combination with cyclophosphamide in the treatment of recurrent unresectable chondrosarcomas.(再発した切除不能の軟骨肉腫の治療におけるmTOR阻害剤とシクロフォスファミドの併用療法の臨床的有効性)Cancer Chemother Pharmacol. 70(6):855-60. 2012年
軟骨肉腫は稀な腫瘍で、外科切除で腫瘍を取り除くことが最も基本的な治療です。再発したり大きくなって切除ができない場合は、抗がん剤や放射線治療が行われますが、軟骨肉腫は抗がん剤や放射線に感受性が低いので、外科切除の対象にならない場合は、極めて予後不良となります。 この論文では、このような再発性の切除不能の進行した軟骨肉腫の患者10例を対象にして、ラパマイシン(シロリムス)とシクロフォスファミドを併用した抗がん剤治療の効果を検討しています。その結果、1例では腫瘍の縮小がみられ、6例では6ヶ月以上の進行停止がみられ、3例が病状進行という結果でした。無増悪生存期間の中央値は13.4ヶ月(3から30.3ヶ月)でした。大きな副作用は認めなかったということです。 除不能の軟骨肉腫の抗がん剤治療としてラパマイシンとシクロフォスファミドは有望な組合せであると、この論文の結論で述べています。
【糖尿病治療薬メトホルミンは解糖系とミトコンドリアでATP産生を阻害する】
メトホルミン(metformin)は、世界中で1億人以上の2型糖尿病患者に使われているビグアナイド系経口血糖降下剤です。糖尿病だけでなくがんの予防や治療の分野でも注目されており、がんの発生を予防する効果やがん細胞の抗がん剤感受性を高める効果が報告されています。 ATP産生を阻害する効果や、がん細胞の増殖を抑える様々な効果を有するAMP活性化プロテインキナーゼ(AMPK)を活性化する効果や、インスリンの分泌を低下させる作用など、多彩な抗腫瘍効果を持ちます。
ビグアナイド剤は、中東原産のマメ科のガレガ(Galega officinalis)から1920年代に見つかったグアニジン誘導体から開発された薬です。ガレガは古くから、糖尿病と思われる病気(口渇や多尿)の治療に経験的に使われ有効性が認められており、その関係でこのガレガから血糖降下作用のあるビグアナイドが発見されました。
メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を介した細胞内シグナル伝達系を刺激することによって糖代謝を改善します。すなわち、筋・脂肪組織においてインスリン受容体の数を増加してインスリン作用を増強し、グルコースの取り込みを促進します。さらに肝臓に作用して糖新生を抑え、腸管でのグルコース吸収を抑制する作用があります。 これらの作用はインスリンの血中濃度を低下させます。
インスリンはがん細胞の増殖を促進するので、インスリンの血中濃度を減らすだけで、がん細胞の増殖を抑制する効果があります。 さらに、AMPKはインスリンおよびインスリン様成長因子-1(IGF-1)によって活性化されるPI3K/Akt/mTORC1シグナル伝達系のmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性を抑制します。また、脂質合成を阻害する作用もあります。がん細胞が分裂して数を増やすためには細胞膜に必要な脂質の合成を増やす必要があります。したがって、がん細胞では脂質合成が亢進しており、脂質合成の阻害剤は抗がん剤として有効であることが報告されています。
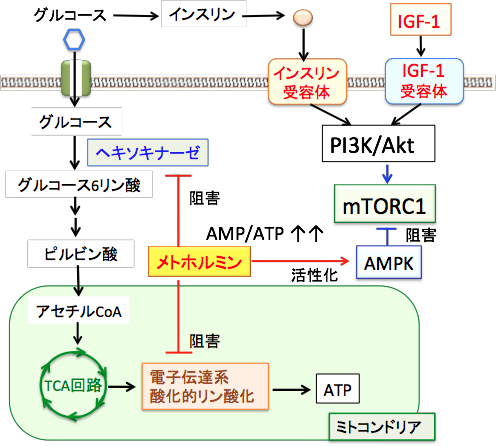
メトホルミンはミトコンドリアの呼吸酵素複合体1(電子伝達複合体1)を阻害してATPの産生を減らし、そのためにAMP:ATP比が上昇するためにAMPKが活性化されます。つまり、メトホルミンはミトコンドリア毒であり、この毒を適量使うと血糖を低下させることができるという訳です。 最近の研究では、メトホルミンは、解糖系でグルコースをグルコース-6-リン酸へ変換するヘキソキナーゼを阻害する作用が報告されています。2-デオキシ-D-グルコースと類似の作用です。
つまり、メトホルミンは解糖系とミトコンドリアの両方でATP産生を阻害し、がん細胞のエネルギー産生を直接抑制すると同時に、AMPKを活性化して抗腫瘍効果も発揮します。
メトホルミンはミトコンドリアの電子伝達系の呼吸酵素を阻害する作用と解糖系のヘキソキナーゼを阻害する作用によってATPの産生を減らし、AMP/ATP比が増加することによってAMP活性化プロテインキナーゼ(AMPK)が活性化される。AMPKはインスリンやインスリン様成長因子-1(IGF-1)によって活性が亢進するmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制する。
【AMPKは細胞内のエネルギーセンサー】
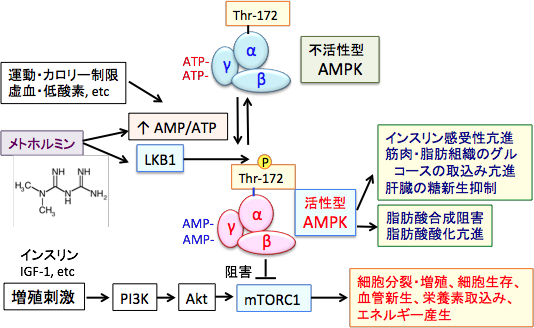
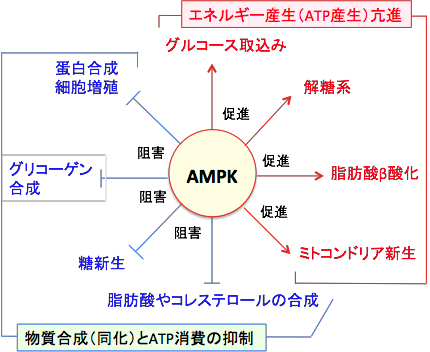
AMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)は人から酵母まで真核細胞に高度に保存されているセリン/スレオニンキナーゼ(セリン/スレオニンリン酸化酵素)の一種で、細胞内のエネルギーのセンサーとして重要な役割を担っています。 AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化されます。
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。 その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1(Liver Kinase B1)に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます( 下図)。 リン酸化されたAMPKはmTORC1を抑制し、タンパク質や脂肪酸の合成を低下させてがん細胞の増殖を抑制します。つまり、LKB1はAMPKを活性化する作用によってがん細胞の増殖を抑制する作用があるがん抑制遺伝子になります。 AMP/ATP比を上昇させてAMPKを活性化するメトホルミンががん予防効果や抗がん作用を示す主要なメカニズムがAMPKの活性化です。 しかし、肺がんや子宮内膜がんなど多くのがんでLKB1遺伝子の変異が認められ、機能が失活しています。つまり、LKB1遺伝子に変異がある場合は、メトホルミンの抗腫瘍効果は減弱することになります。
AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っている。AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化される。AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する。γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される。 LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化する。 リン酸化されたAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制する。
細胞内ATPの減少を感知して活性化したAMPKは、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる作用があります。すなわち、AMPKが活性化すると糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生されます(図)。物質合成が抑制されることは細胞の増殖が抑制されることになります。
AMP活性化プロテインキナーゼ(AMPK)の代謝調節作用。AMPKはATPの減少を感知して活性化され、物質合成(同化)とATP消費を抑制し、ATP産生を亢進して、細胞内ATP量を増やす作用がある。物質合成が抑制されるので、がん細胞の増殖も抑制される。
【臨床試験で証明されたメトホルミンの抗がん作用】
インスリン抵抗性を改善することは老化やがんの予防に有効であるため、メトホルミンはがん予防や抗老化の薬としても注目されています。メトホルミンの抗がん作用に関する基礎研究は1970年代から行われており、2000年代には動物発がん実験でメトホルミンの発がん予防効果が報告されています。 メトホルミンの抗がん作用のメカニズムに関して多くの報告があります。
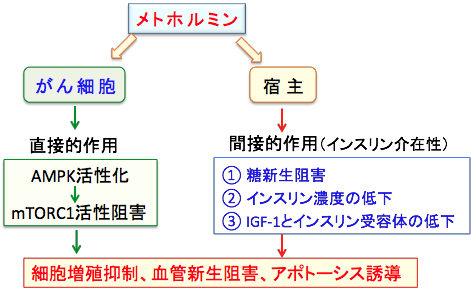
がん細胞に対する直接作用はAMPK活性化とmTORC1の活性阻害によって増殖抑制や血管新生阻害作用を発揮します。宿主に対する間接的な抗腫瘍効果としてはインスリン感受性を高めることによって糖新生を阻害したり、インスリンやインスリン受容体やインスリン様成長因子-1(IGF-1)を低下させる作用が抗腫瘍的に作用します(下図)。
メトホルミンはがん細胞に対する直接的作用とインスリンを介した間接的な作用など、様々なメカニズムで抗がん作用を発揮する。
人間でのがん予防効果が最初に指摘されたのは2005年の論文で、2型糖尿病患者でメトホルミンを服用しているグループは全てのがんの発生率が低下することが後向きケース・コントロール研究で報告されています(British Medical Journal 330: 1304-1305, 2005)。
メトホルミンが糖尿病患者の膵がんリスクを低下させることを示す結果が報告されています。糖尿病の患者でメトホルミンを服用していた場合、メトホルミンを服用しなかった人々と比べて、膵がんのリスクが 62 %低減することが示されています。一方、インスリンまたはインスリン分泌促進薬を使用した糖尿病患者では、それらを使用しなかった患者と比較して、それぞれ、膵がんのリスクが 4.99 倍と 2.52 倍に増加しました。(Gastroenterology 137:482-488, 2009)
台湾で実施された80万人を対象にした前向きコホート研究では、2型糖尿病があって血糖降下剤を服用していないグループでは、大腸がん・肝臓がん・胃がん・膵臓がんの発生率が約2倍に高く、メトホルミンの服用によって非糖尿病グループのレベルに低下することが報告されています。この論文では、1日500mgのメトホルミンががん(特に、胃がん、結腸直腸がん、肝臓がん、膵臓がん)の発生率を著明に低下させるという結論が記述されています。(BMC Cancer 2011 Jan 18: 11(1):20)
その後も、多くのがんで、メトホルミンのがん予防効果や抗がん作用が報告されており、最近では、非糖尿病のがん患者に対してメトホルミンの抗がん作用が検討されています。 メトホルミンががん細胞やがん幹細胞の抗がん剤感受性を高める作用、転移を抑制する作用などが数多く報告されています。抗がん剤や放射線治療中にメトホルミンを同時に服用すると、腫瘍縮小効果が高まることが乳がんや食道がんや大腸がんなど多くのがんで確認されています。
メトホルミンはインスリン感受性を高めて、少ないインスリン分泌で血糖のコントロールを可能にする薬なので、インスリン分泌を刺激する糖尿病治療薬と異なり、糖尿病がない人が服用しても低血糖にはなりにくい薬です。そのため、米国などでは非糖尿病のがん患者に1日1500mg前後のメトホルミン投与で抗腫瘍作用が検討されています。最近の報告として以下のような論文があります。
Metformin: A Potential Therapeutic Agent for Recurrent Colon Cancer(メトホルミン:再発性大腸がんに対する潜在的な治療薬)PLoS One. 2014; 9(1): e84369.
【要旨】 ビグアナイド系の糖尿病治療薬のメトホルミンが抗がん作用を有することを示すエビデンスが集まっている。しかし、メトホルミンの抗がん作用に関する研究の多くは原発がんを対象にしたものである。 メトホルミンが再発がんに対しても有効な抗腫瘍効果を示すかどうかを検討した報告はまだ無い。特に、50%以上の患者が標準的な抗がん剤治療を受けている結腸直腸がんの再発に対する効果を知ることは有用である。
がんの再発のメカニズムは十分に解明されているわけではないが、抗がん剤に抵抗性のがん幹細胞が治療に対して抵抗性で生き残るためと考えられている。 したがって、がん幹細胞をターゲットにした毒性の少ない治療戦略の開発は、再発大腸がんの治療効果を高める上で極めて重要である。
この研究では、抗がん剤抵抗性のがん幹細胞に対する5-フルオロウラシル(5-FU)とオキサリプラチンの併用治療にさらにメトホルミンを追加した場合の有効性について検討した。
実験結果は、メトホルミンが 5-FUとオキサリプラチンの抗腫瘍効果に相乗的に作用して、抗がん剤抵抗性の大腸がん細胞株(HT-29とHCT-116)に細胞死を誘導し、がん幹細胞の増殖による細胞塊の形成を阻害した。 培養細胞を使用した実験では、5-FUとオキサリプラチンとメトホルミンの併用は抗がん剤抵抗性の大腸がん細胞の移動を阻害した。 この変化はマイクロRNA 145(miRNA 145)の増加とマイクロRNA 21(miRNA21)の増加と関連していた。また、大腸がんの増殖を促進するWnt/βカテニン・シグナル伝達系は抑制されていた。
抗がん剤抵抗性の大腸がん細胞(HCT-116とHT-29)を免疫不全マウスに移植した移植腫瘍の動物実験モデルでの検討では、5-FUとオキサリプラチンにメトホルミンを併用することによって移植腫瘍の増殖速度を顕著に抑制できた。
我々の実験結果は、再発した抗がん剤抵抗性の大腸がんに対して、標準的な抗がん剤治療にメトホルミンを併用することが有効であることを示唆している。Metformin enhances tamoxifen-mediated tumor growth inhibition in ER-positive breast carcinoma(エストロゲン受容体陽性の乳がん細部に対するタモキシフェンの増殖抑制作用をメトホルミンは増強する)BMC Cancer. 2014; 14: 172.
【要旨】
背景:乳がんのホルモン療法で使用されるタモキシフェンはエストロゲンとエストロゲン受容体(ER)の結合を阻害して増殖抑制効果を発揮する。しかしながら、ER陽性乳がんの多くの患者はタモキシフェンによる抗腫瘍効果が弱かったり、あまり効果が出ない場合もある。メトホルミンは糖尿病治療薬として広く使用され、抗がん作用があることが報告されている。この研究では、ER陽性の乳がんのタモキシフェン治療にメトホルミンを併用することによって抗腫瘍効果の増強作用があるかどうかを検討した。
方法:ER陽性乳がん細胞に対するメトホルミン単独およびメトホルミンとタモキシフェンの併用の場合の作用を、細胞生存、DNA合成活性、コロニー形成能、フローサイトメトリー、免疫染色、ヌードマウスへの移植腫瘍を使った実験モデルで検討した。
結果:タモキシフェンとメトホルミンを併用すると、乳がん細胞の増殖抑制に必要なタモキシフェン濃度は著明に減少した。 さらに、タモキシフェンによる乳がん細胞の増殖、DNA合成活性、コロニー形成能、軟寒天コロニー形成能の阻害作用をメトホルミンは増強し、タモキシフェンによるアポトーシス誘導作用を亢進した。この作用は、bax/bcl-2アポトーシス・シグナル伝達系とAMPK/mTOR/p70S6細胞増殖シグナル伝達系が関与していた。さらに、移植腫瘍を用いた動物実験で、タモキシフェンとメトホルミンの併用は腫瘍の成長を顕著に抑制した。
結論:メトホルミンとタモキシフェンの併用はER陽性乳がん細胞の増殖を相加的に阻害し、アポトーシス誘導を増強した。ER陽性乳がんの治療にメトホルミンとタモキシフェンの併用は抗腫瘍効果の増強が期待できるので、さらに臨床例での検討が必要である。Antidiabetic Drug Metformin Prevents Progression of Pancreatic Cancer by Targeting in Part Cancer Stem Cells and mTOR Signaling. (抗糖尿病薬のメトホルミンはがん幹細胞とmTORシグナルを介して膵臓がん細胞の進展を阻害する)Transl Oncol. Dec 2013; 6(6): 649–659.
【要旨】
多くの疫学データは糖尿病が膵臓がんの発生リスクを高めることを明らかにしている。そして近年のメタ解析によって、糖尿病治療薬のメトホルミンが膵臓がんの発生リスクを減らすことが明らかになっている。 膵臓がんを発生するように遺伝子改変したトランスジェニックマウスを用い、膵臓がん発生過程に対するメトホルミンの効果を検討した。
コントロール食を投与されたマウスの膵臓がん発生率はオスが80%でメスが62%であった。 メトホルミンを1000ppmで投与すると膵臓がんの発生率はオスで20%、メスで7%であり、2000ppmのメトホルミン投与量の場合の膵臓がん発生率はオスで26%でメスで0%であった。 1000~2000ppmのメトホルミンの投与で発生した膵臓がんの重要はコントロール群の34~49%をしめした。 メトホルミン投与は早期膵臓がん病変(上皮内がん)の発生を28から39%抑制し、膵臓がん細胞の広がりを顕著に抑制した。
メトホルミンを投与されたマウスの膵臓組織および血清のmTOR(哺乳類ラパマイシン標的タンパク質)、ERK(extracellular signal-regulated kinases)、リン酸化されたpErk(extracellular signal-regulated kinases)、インスリン様成長因子-1、などの低下を認めた。膵臓組織におけるがん幹細胞のマーカーの発現は顕著に低下していた。
以上の結果より、メトホルミンはがん幹細胞を減らし、mTORシグナル伝達系を抑制する作用があることが示唆された。この前臨床試験の結果は、膵臓がんの化学予防の臨床試験にメトホルミンを検証する価値があることを意味している。Metformin intake associates with better survival in ovarian cancer: A case control study(メトホルミン摂取は卵巣がんの生存率を高める:ケースコンロトール研究)Cancer. Feb 1, 2013; 119(3): 555–562.
【要旨】
背景:卵巣がん患者の生存とメトホルミン摂取の関連を検討する目的で研究を行った。
方法:この後ろ向きケースコントロール試験(症例対照試験)ではメトホルミンを服用している卵巣がん患者と、ステージや年齢などの条件を合わせたコントロール(メトホルミンを服用していない卵巣がん患者)を比較した。
結果:メトホルミンを服用していた卵巣がん患者72例と対照143例の予備試験の解析では、5年生存率はメトホルミン服用群が73%に対して対照群は44%で、統計的に有意な差を認めた(p=0.0002)。
メトホルミン服用群61例、(全ての条件を症例群に合わせた選択した)対照群178例の解析では、5年生存率はメトホルミン服用群で67%、対照群で47%であり、統計的に有意な差を認めた(p=0.007)。
結論:メトホルミンの服用は卵巣がん患者の生存率を高める。したがって、卵巣がん患者における臨床試験を実施する価値がある。以上のように、まだ基礎研究の段階の報告が多いのですが、非糖尿病患者を対象にした臨床試験も行われており、がん幹細胞の抗がん剤感受性を高める作用などが報告されています。
非糖尿病患者でも、大腸がんや乳がんや膵臓がんや卵巣がんなど多くのがんの治療にメトホルミンを1日500~1500mg程度併用することは有用と考えられます。 また、がん細胞の解糖系とmTORC1をターゲットにしたがん治療としてメトホルミンとラパマイシンと2−デオキシ-D-グルコースの組合せに糖質制限あるいはケトン食の併用は理論的には抗腫瘍効果を期待できます(下図)。実際に進行がんで複数の有効例を経験しています。
がん細胞のエネルギー産生系(解糖系と酸化的リン酸化)とmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)をターゲットにすると、がん細胞の増殖を抑制できると同時に正常細胞の老化を抑制し寿命を延ばす可能性が老化研究から示唆されている。老化研究で寿命を延ばす作用が検討されてるラパマイシン、メトホルミン、2-デオキシ-D-グルコース(2-DG)、カロリー制限、糖質制限、ケトン食の組合せは、がんと共存しながら寿命を延ばす治療法といえる。
上記の治療法の1ヶ月分の費用の目安は以下です。
・2-デオキシ-D-グルコース :30,000円〜60,000円 (50g〜100g/月)
糖質制限やケトン食を行っている場合は1日服用量は体重1kg当たり20〜30mgです。体重50kgの場合で1日に1〜1.5gの服用になります。(1ヶ月に30g〜45g)
50gが30,000円で処方しています。メトホルミンは1日に500〜1500mgを目安に服用します。治療の状況や体力などによって服用量を加減します。糖質制限やケトン食を行っているときは1日500mg〜1000mgを目安にしています。1錠(250mg)が50円です。
上記に加えて、低用量ナルトレキソン療法(1ヶ月分が9000円)やオピオイド増殖因子の点滴(週1回、1回25000円)を併用すると抗腫瘍効果を高めることができます。(低用量ナルトレキソン療法とオピオイド増殖因子についてはこちらへ)