メトロノミック化学療法と免疫療法の組み合わせによるがん治療
◉ 標準治療の抗がん剤治療は最大耐用量を投与する
通常の化学療法(抗がん剤治療)は、副作用が耐えられる最大量(最大耐用量)を投与してがん細胞を短期間で死滅させる方法が基本になっています。この最大耐用量の化学療法はがん細胞を死滅させることが目的なので、できるだけ大量の抗がん剤を使うのが良いと考えます。白血病や悪性リンパ腫ではこの方法が有効です。
しかし、固形がんの場合は、この方法は必ずしも有効ではありません。 精巣腫瘍や小細胞性肺がんのように抗がん剤治療が著効を示す固形がんもありますが、多くの固形がん(肺がんや膵臓がんや胃がんなど)に対しては、抗がん剤の効き目は極めて限定的です。 固形がんの多くは抗がん剤治療に抵抗性を示し、抗がん剤治療だけでは全身に広がったがん細胞を根絶させることは、ほぼ不可能です。抗がん剤の投与量を増やせば増やすほど、がん細胞を死滅させる効果は強くなります。しかし一方、抗がん剤の投与量が増えれば増えるほど正常細胞のダメージによる副作用が強くなり、投与量が限界を超えれば患者さん自身が死亡してしまいます。
患者さんが副作用に耐えられる投与量の範囲で最大限の投与量を設定するのが、最も効果が高いという意見が主流ですが、これはがん細胞だけをターゲットにしているからです。この最大耐用量の抗がん剤投与の方法には様々なデメリットと欠陥が指摘されています。
正常組織にダメージを与えて強い副作用を引き起こすだけでなく、免疫力を低下させたり、がん組織の血管新生を促進する可能性や、抗がん剤耐性のがん細胞の出現を促進する可能性などが指摘されています。
◉ 低用量の抗がん剤を継続的に投与するメトロノミック化学療法
最大耐用量を投与する標準的な抗がん剤治療に代わって、最近注目を集めているのが、低用量頻回投与の抗がん剤治療で、メトロノミック化学療法(Metronomic Chemotherapy)と呼ばれる治療法です。
メトロノミックとは、リズムを刻む「メトロノームの様な」という意味で、メトロノミック化学療法とは、メトロノームのように規則的に低用量の抗がん剤を頻回に投与していく抗がん剤治療法です。
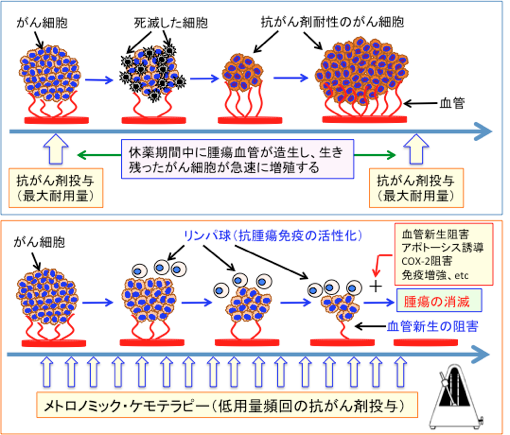
最大耐用量を投与する抗がん剤治療では、正常組織のダメージを回復させる期間をもうけるために、週一回とか月に一回というように間歇的な投与法になりますが、この休薬期間に腫瘍血管内皮細胞が急速に再生し、腫瘍血管の新生が亢進して、腫瘍の増大が起こります。
一方、メトロノミック化学療法(休薬期間をもうけない長期間の低用量投与)では、腫瘍の増大に必要な血管新生を抑制でき、がん細胞の増殖を阻止できると考えられています。 さらに、低用量の投与であるため、副作用が少なく、また免疫細胞の働きを抑えている制御性T細胞の働きを阻害するので、免疫力はむしろ高くなるという効果も報告されています。
最大耐用量の化学療法が「がん細胞の死滅」を目標にしているのに対して、メトロノミック化学療法は血管内皮細胞(血管新生)と免疫を抑制している細胞をターゲットにしているのです。(下図)
近年、メトロノミック化学療法の有効性を示す報告が多くなっており、最大耐用量を投与する現行の抗がん剤治療に代わる「体にやさしい抗がん剤治療法」として注目されつつあります。
図:通常の抗がん剤治療は、副作用に耐えられる最大量(最大耐用量)の抗がん剤を投与する。この場合、正常組織へのダメージも強いので副作用も強く現れる。また、正常組織のダメージを回復させる必要があるため、抗がん剤投与の間に休薬期間が必要であるが、この休薬期間に腫瘍血管が急速に再生し、生き残ったがん細胞が増殖する。抗がん剤が効きにくい強いがん細胞が選択的に生き残るので、がん組織は次第に抗がん剤が効きにくい細胞が多くなってくる。(図の上)
一方、休薬期間を設けないで、メトロノームのように定期的に頻回に低用量の抗がん剤を投与するメトロノミック・ケモテラピー(Metronomic Chemotherapy)では、血管新生が抑制されて抗腫瘍効果を発揮する。また、低用量の抗がん剤投与は副作用が少なく、免疫系組織の抑制も回避できる。低用量の抗がん剤投与は腫瘍免疫を抑制する制御性T細胞の活性を阻害する作用があり、その結果、がん細胞を排除する抗腫瘍免疫が増強される。メトロノミック・ケモテラピーだけでは抗腫瘍効果に限界があるが、血管新生阻害やアポトーシス誘導やシクロオキシゲナーゼ-2(COX-2)阻害や免疫増強などの治療法を併用すると、さらに抗腫瘍効果を高め、腫瘍を消滅させることも可能になる(下の図)。
◉ 寄生虫治療薬はがんにも効く:メベンダゾールとイベルメクチン
寄生虫の治療に使われる薬ががんにも効くという例が数多く知られています。 これらは副作用が少なく安全性が高く、比較的安価なので、これらの寄生虫治療薬を複数組み合わせたがん治療の可能性が指摘されています。
メベンダゾールはベンズイミダゾール系の広範囲作用型の寄生虫治療薬(駆虫薬)です。線虫、条虫(サナダムシ)、回虫など多くの寄生虫に広く作用します。
培養細胞(in vitro)や動物実験(in vivo)やコンピュータ解析(in silico)など複数の実験系で強い抗がん活性が報告されています。 メベンダゾールが寄生虫を死滅させる作用機序として、チュブーリンの重合を阻害して、細胞の分裂に重要な役割を果たす微小管の働きを阻害する効果が提示されています。 微小管阻害としてパクリタキセル(商品名;タキソール)やビンクリスチンなどがあります。 パクリタキセル(paclitaxel)はチューブリン (tubulin) の重合を促進することにより微小管 (microtubule) を安定化し、がん細胞の分裂を阻害します。
微小管はαとβのチューブリンの2量体から形成され、タキソールはその内β-チューブリンに結合し、その重合を促進することにより抗がん作用を示します。
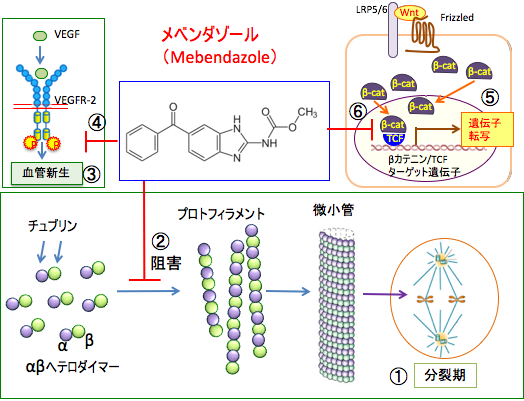
一方、メベンダゾールはチューブリンに結合して微小管の重合を阻害します。メベンダゾールはチューブリンのコルヒチン結合ドメインに結合します。 メベンダゾールはその他に、血管新生阻害、Wnt/βカテニン経路阻害、ヘッジホッグシグナル伝達系阻害など多彩なメカニズムによる抗がん作用があります。(下図)
図:細胞分裂の際に複製されたDNA(染色体)は微小管によってそれぞれの細胞に分けられる(①)。微小管はαチューブリンとβチューブリンが結合したヘテロ二量体を基本単位として構成され、チュブリンのヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び、これが13本集まって管状の構造(直径25nm)になったものが微小管となる。メベンダゾールはチューブリンに結合して微小管の重合を阻害し、細胞分裂のM期を停止させてアポトーシスを起こす(②)。血管内皮細胞の血管内皮細胞増殖因子受容体-2(VEGFR-2)に血管内皮細胞増殖因子(VEGF)が結合するとVEGFR-2は二量体を形成し、チロシンキナーゼドメインに存在するチロシン残基の自己リン酸化が引き起こされ、細胞内のシグナル伝達系が活性化され、血管内皮細胞の増殖や血管形成が促進されて血管新生が促進する(③)。メベンダゾールはVEGFR-2の活性化を阻止して血管新生を阻害する(④)。Wntが受容体のFrizzledとLRP5/6に結合してWntシグナルが活性化されるとβ-カテニンが細胞質内で増加して核内に移行して転写因子のTCFに結合し、β-カテニン/TCFのターゲット遺伝子(c-mycやサイクリンD1など)の転写を活性化して、細胞の増殖を亢進する(⑤)。 メベンダゾールはTCFを活性化するキナーゼのTNIK (Traf2- and Nck-interacting kinase)を阻害してTCFの転写活性を阻害する(⑥)。このように、メベンダゾールは多彩なメカニズムで、がん細胞の増殖を阻止し、細胞死を誘導する。 イベルメクチンは、土壌から分離された放線菌Streptomyces avermitilisの発酵産物から単離されたアベルメクチン類から誘導されました。日本国内では、腸管糞線虫症と疥癬の治療薬として保険適用されています。 イベルメクチンは、中南米やアフリカのナイジェリアやエチオピアで感染者が多く発生している糸状虫症の特効薬です。糸状虫症はオンコセルカ症や河川盲目症とも呼ばれ、激しい掻痒、外観を損なう皮膚の変化、永久失明を含む視覚障害を起こします。その他、リンパ系フィラリア症など多くの種類の寄生虫疾患に有効で、人間だけでなく、動物の寄生虫疾患治療薬として広く使用されています。
イベルメクチンは、無脊椎動物の神経・筋細胞に存在するグルタミン酸作動性クロール(Cl)チャネルに選択的かつ高い親和性を持って結合します。その結果、クロール(Cl)に対する細胞膜の透過性が上昇して神経又は筋細胞の過分極が生じ、その結果、寄生虫が麻痺を起こし、死に至ります。哺乳類ではグルタミン酸作動性クロールチャネルの存在が報告されていないので、安全性は極めて高いと言えます。
このように、イベルメクチンの安全性は非常に高く、寄生虫に感染した人間に対して、寄生虫が死滅する過程で引き起こされる免疫応答や炎症反応に起因する症状以外には、副作用をほとんど起こらないと言われています。 さらに、多数の前臨床試験で抗がん作用が確認されています。 培養細胞を使った実験では、乳がん、卵巣がん、前立腺がん、頭頸部がん、大腸がん、膵臓がん、悪性黒色腫など多くのがん種で抗腫瘍効果が報告されています。 がん細胞の増殖抑制やアポトーシス誘導だけでなく血管新生阻害作用を示すことも報告されています。
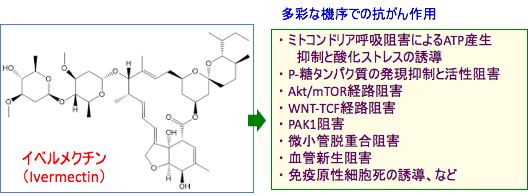
動物実験でも抗腫瘍効果が認められています。 イベルメクチンの抗がん作用のメカニズムとして、ミトコンドリア呼吸阻害、酸化ストレスの誘導、Akt / mTOR経路の阻害、WNT-TCF経路の阻害、PAK-1阻害、血管新生阻害などが報告されています。メベンダゾールと同様に、イベルメクチンがチューブリンと結合して微小管の働きを阻害する作用も報告されています。
イベルメクチンのin vitroおよびin vivoの抗腫瘍活性は、健康な人間および寄生虫感染患者で行われたヒト薬物動態研究に基づいて臨床的に到達可能な濃度で達成されることが明らかになっています。
図:イベルメクチンは多彩な機序で抗腫瘍活性を発揮する。
まとめ:寄生虫治療薬のメベンダゾールとイベルメクチンは、様々なメカニズムで抗腫瘍活性を発揮する。寄生虫治療においても併用されることが多い。がん治療においても併用することによって、抗腫瘍効果を相乗的に高めることができる。
◉ メトホルミンとビタミンD3はAMPKを活性化する
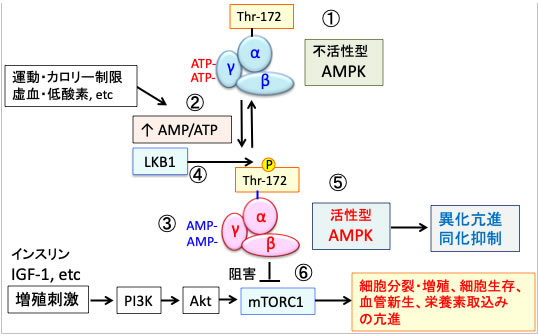
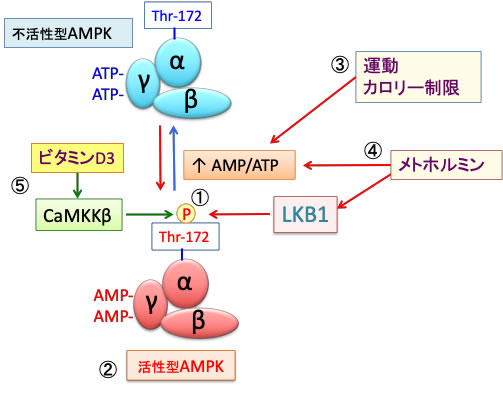
AMP活性化プロテインキナーゼ (AMPK)はグルコース欠乏や低酸素などにより細胞内ATP量が減少すると、AMP/ATP 比の増加に伴いAMPKが活性化されます。AMPKはmTORC1活性を抑制して、異化作用の亢進や細胞成長の停止をもたらし、エネルギー消費の抑制(同化抑制)とエネルギー産生の亢進(異化促進)へと細胞の代謝をシフトさせます。(下図)
図:AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する(①)。運動やカロリー制限や虚血や低酸素などによってATPが減少してAMP/ATP比が上昇すると(②)、γサブユニットに結合していたATPがAMPに置換する(③)。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる(④)。活性化したAMPKは異化を亢進してエネルギー産生を亢進し、物質合成(同化)を抑制するように代謝をシフトする(⑤)。活性化したAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を阻害し(⑥)、がん細胞の増殖抑制や、抗老化や寿命延長の効果を引き起こす。
AMPKは運動やカロリー制限の他、メトホルミンやビタミンD3で活性化できます。
メトホルミンはミトコンドリアの呼吸鎖を阻害してATP産生を低下させる機序とLKB1を活性化する両方の機序でAMPKを活性化します。
ビタミンD3は細胞内のフリーのカルシウムを増加させ、カルモジュリンキナーゼキナーゼβ (CaMKKβ)を活性化させてAMPK活性を亢進します。つまり、異なる機序でAMPKを活性化するので、相乗効果が期待できます。(下図)。
図:AMPKの172番目のスレオニン(Thr-172)がLKB1でリン酸化されると(①)、AMPKは最大に活性化される(②)。運動やカロリー制限はATPが減少してAMP/ATP比を上昇してAMPKを活性化する(③)。メトホルミンはミトコンドリアの呼吸鎖を阻害してATP産生を低下させる機序とLKB1を活性化する両方の機序でAMPKを活性化する(④)。ビタミンD3は細胞内のフリーのカルシウムを増加させ、カルモジュリンキナーゼキナーゼβ (CaMKKβ)を活性化させてAMPK活性を亢進する(⑤)。
以下のような報告があります。AMPK/mTORシグナル伝達経路の阻害作用においてビタミンD3とメトホルミンは相乗効果があるという報告です。
Vitamin D3 potentiates the growth inhibitory effects of metformin in DU145 human prostate cancer cells mediated by AMPK/mTOR signalling pathway(ビタミンD3 は、AMPK/mTOR シグナル伝達経路を介した DU145 ヒト前立腺がん細胞におけるメトホルミンの増殖抑制効果を増強する)Clin Exp Pharmacol Physiol. 2015 Jun;42(6):711-7
【要旨】
メトホルミンとビタミンD3 は両方とも、ヒト前立腺がん細胞を含む多数のがん細胞株で強力な抗増殖作用を示す。ここでは、2 つの薬剤の組み合わせが、DU145 ヒト前立腺がん細胞の増殖に対して、いずれかの薬剤単独よりもはるかに強い増殖抑制効果を与えることを示した。 メトホルミンとビタミン D3 は、培養 DU145 細胞の細胞増殖とアポトーシス誘導に対して相乗効果を示した。 抗腫瘍作用のメカニズムとして、G1/S期での細胞周期の停止、AMPKのリン酸化による活性化とそれに続く下流のmTORシグナル伝達経路の阻害、c-Myc発現の抑制、および抗アポトーシスタンパク質p-Bcl-2のレベルの低下の関与が示された。結論として、メトホルミンとビタミン D3 は相乗的に DU145 細胞の増殖を阻害し、アンドロゲン非依存性前立腺癌の治療に対する有望な臨床治療戦略を示している
メトホルミンとビタミンD3は両方ともAMP活性化プロテインキナーゼを活性化しますが、そのメカニズムは異なります。従って、AMPK活性化において相乗効果が期待できます。
駆虫薬のイベルメクチンはAkt/mTORC1経路を阻害します。さらにWnt/βカテニン経路を阻害する作用もあります。メベンダゾールもWnt/βカテニン経路を阻害します。したがって、イベルメクチンとメベンダゾールメトホルミンとビタミンD3は相乗効果が期待できます。
◉ 2-デオキシ-D-グルコースはがん細胞の解糖系を阻害する
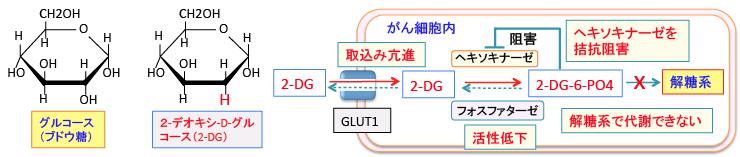
2-デオキシ-D-グルコース(2-Deoxy-D-glucose)は、グルコース(ブドウ糖)の2位の水酸基(OH)が水素原子(H)に置換された物質(グルコース誘導体)です。2-デオキシグルコース(2-DG)はグルコースと同じようにグルコース輸送体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれます。
グルコースと2-DGは細胞内に入るとヘキソキナーゼ(Hexokinase)によってリン酸化され、グルコース-6-リン酸あるいは2-デオキシ-D-グルコース-6-リン酸(2-DG-6-リン酸)に変換されます。リン酸化されるとグルコース・トランスポーター(GLUT1)を通過できないため細胞外へ出れなくなります。このヘキソキナーゼによる6位のリン酸化は解糖系によるグルコースの代謝の最初のステップで、細胞内に取込んだグルコースを細胞内にとどめておく目的があります。
リン酸化反応後は、グルコース-6-リン酸はさらに解糖系で代謝されてエネルギー産生に使われ、ペントース・リン酸経路で核酸などの物質合成の材料としても利用されます。
しかし、2-DG-6-リン酸は、解糖系酵素で代謝できないため、細胞内に蓄積します。グルコース-6-リン酸や2-DG-6-リン酸を脱リン酸化するフォスファターゼが糖新生を行う肝臓や腎臓の細胞にはありますが、多くのがん細胞はフォスファターゼの活性が低いので、一旦入った2DGは2DG-6-リン酸に変換されたあとは細胞外に出ることができず、さらにそれ以上代謝されることもできないので、2-DG-6-リン酸の状態でどんどん蓄積します。
2-DGによってエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーターの発現がさらに増え、2-DGの取り込みをさらに増やすことにもなります。したがって、がん細胞は正常細胞に比べてより2-DGの取込みが増えます。
細胞内で蓄積した2-DG-6-リン酸はヘキソキナーゼとヘキソース・フォスフェート・イソメラーゼを阻害します(拮抗阻害)。
したがって、2-DGを経口摂取すると、がん細胞に多く取り込まれ、がん細胞の解糖系を阻害するので、グルコースの代謝によるエネルギー産生と物質合成を阻害することになります。(下図)
図:2-デオキシ-D-グルコース(2-DG)はグルコース・トランスポーター(GLUT1)によって細胞内に取り込まれる。がん細胞はGLUT1の発現量が増え、グルコースと同時に2-DGも多く取り込む。2-DGはヘキソキナーゼで2-DG-6リン酸に変換されるが、それ以上代謝されない。がん細胞はフォスファターゼの活性が低いので、2-DG-6-リン酸ががん細胞内に蓄積する。2-DG-6-リン酸はヘキソキナーゼをフィードバック阻害するので、 2-DG-6-リン酸を取り込んだがん細胞はグルコースの解糖系での代謝が阻害される。その結果、がん細胞のエネルギー産生と物質合成は阻害されることになる。
一般的にグルコースの取込みの多いがん細胞ほど増殖が早く、悪性度が高く、予後が悪いと言えます。 取り込まれたグルコースがエネルギー産生と細胞を構成する成分の合成に使われるからで、グルコースの取込みが多いことは増殖活性が高いことを意味します。
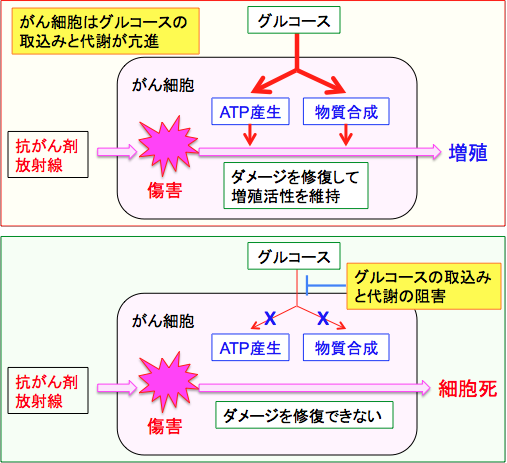
したがって、がん細胞におけるグルコースの取込みや解糖系での代謝を阻害するとがん細胞の増殖活性を低下させることができます。 また、抗がん剤治療や放射線治療にグルコースの取込みや解糖系を阻害する治療を併用すると、抗がん剤や放射線治療の効き目を高めることができます。 がん細胞が抗がん剤や放射線でダメージを受けても、エネルギー(=ATP)と細胞成分を作る材料、すなわちグルコースが十分に供給されておれば、ダメージを修復して増殖を続けることができます。しかし、がん細胞におけるグルコースの取込みや利用を阻害すれば、ダメージを修復することができません。 グルコースの取込みやエネルギー産生過程を阻害する方法は、抗がん剤や放射線に対するがん細胞の感受性を高める効果が期待でき、がん治療の重要なターゲットになっています。(下図)
(上)がん細胞はグルコースの取込みと代謝(解糖系とペントース・リン酸経路)が亢進してATP産生と細胞を構成する物質(細胞膜や核酸など)の合成が亢進している。抗がん剤や放射線照射によって細胞がダメージを受けても、ATP産生と物質合成が十分であれば、ダメージを修復して増殖活性を維持できる。
(下)グルコースの取込みや代謝が阻害されると、ダメージの修復に必要なATPも物質合成も行えなくなる。そうなると抗がん剤や放射線で受けたダメージを修復できないので、細胞死をきたすことになる。
また、がんや感染症に対する免疫応答で重要な記憶キラーT細胞(memory CD8+T cell)の働きを高めるという報告もあります。以下のような論文があります。Inhibiting glycolytic metabolism enhances CD8+ T cell memory and antitumor function.(解糖系の阻害はCD8+ Tリンパ球の記憶と抗腫瘍作用を亢進する)J Clin Invest. 2013 Oct 1;123(10):4479-88.
抗原と出会う前のT細胞はナイーブT細胞といわれ、この状態では特に何も仕事をしません。 樹状細胞による抗原提示によって活性化されると、ナイーブT細胞は増殖してエフェクターT細胞という仕事をする細胞になります。エフェクター細胞は、病原体やがん細胞を攻撃します。
エフェクター細胞の多くは死滅しますが、一部がメモリーT細胞として残り、長期にわたって体内に維持され、抗原に出会うと直ぐにエフェクター細胞(細胞傷害性T細胞)になって、抗原特異的な免疫応答を起こします。
2-DGはこのメモリーT細胞の数を増やし、抗腫瘍免疫を高めるという報告です。
T細胞のエネルギー産生は、増殖の盛んなエフェクターT細胞では解糖系への依存が高く、増殖活性の低いナイーブT細胞とメモリーT細胞では解糖系への依存は低く、脂肪酸の燃焼によるエネルギー産生に依存しているという特徴があり、そのため、解糖系を阻害する2-DGは免疫記憶を高めるというメカニズムです。以上のように、2-DGは様々なメカニズムで抗腫瘍作用を示します。抗腫瘍免疫を高める効果もあるので、メトロノミック化学療法の効果を高めます。
◉ 低用量のシクロホスファスファミドは抗腫瘍免疫を活性化する
シクロホスファミド(商品名:エンドキサン)は、ナイトロジェンマスタードの流れをくむアルキル化剤に分類される抗悪性腫瘍剤です。免疫抑制剤としてリュウマチ性疾患やネフローゼ症候群の治療にも使われています。
DNAをアルキル化してがん細胞(分裂している細胞)を死滅させます。 がん治療の場合は、1日100~200mgの服用で、自己免疫疾患の場合は1日50mg程度を服用します。
シクロフォスファミドの低用量メトロノミック投与が、抗腫瘍免疫を活性化して、大きな腫瘍を消滅できるという実験結果が報告されています。以下のような報告があります。Metronomic cyclophosphamide eradicates large implanted GL261 gliomas by activating antitumor Cd8+ T-cell responses and immune memory.(シクロホスファミドのメトロノミック投与は、抗腫瘍性のCD8陽性T細胞応答と免疫記憶を活性化することによって、大きなGL261グリオーマ移植腫瘍を消滅させる)Oncoimmunology. 2015 Feb 18;4(4):e1005521.
免疫系が正常なマウスにGL261グリオーマ細胞を移植した実験系を用い、6日おきのシクロホスファミドのメトロノミック投与の効果を検討しました。 シクロホスファミドの6日おきのメトロノミック投与の2サイクルの治療で、腫瘍細胞特異的なCD8陽性細胞傷害性T細胞(CTL)とナチュラルキラー(NK)細胞、マクロファージ、その他の免疫細胞を増やし、活性化しました。 このようなCTLやNK細胞といったエフェクター細胞はシクロホスファミド投与の6日後にピークになりその後減少しました。制御性T細胞の数はCTLやNK細胞と逆の動きを示しました。
間歇的なシクロホスファミドを数回繰り返すことによって腫瘍は縮小し、消滅しました。 腫瘍の消滅にはCD8陽性キラーT細胞(CTL)が必要でした。GL261細胞の再移植に対して、末梢血中のCTLの増加と腫瘍組織でのCTLの浸潤が認められ、抗原特異的な免疫記憶が成立していました。
以上の結果から、抗がん剤のシクロホスファミドの単独の投与でも、その投与量と投与スケジュールを適切化すれば、大きな腫瘍を縮小させ、さらに消滅させ、免疫記憶を成立させることも可能であることが示されました。シクロホスファミドを使ったメトロノミック化学療法は血管新生阻害作用によって抗腫瘍効果を示すと考えられています。しかし最近の研究では、自然免疫の活性化など免疫機能を介したメカニズムの関与が指摘されています。
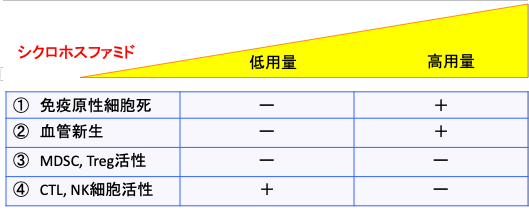
この研究グループは、がん抗原特異的なキラーT細胞の活性化と移植腫瘍の縮小に、シクロホスファミドの間歇的な投薬スケジュールが有効だと報告しています。 シクロホスファミドで死滅すると免疫細胞が認識しやすい免疫原性細胞死を誘導します。 高用量だと、免疫原性細胞死を誘導しますが、免疫系も抑制されます。また、がん組織がダメージを受けると血管新生が促進され、がん組織の増大を招く場合もあります。
一方、低用量のメトロノミック投与の場合、免疫原性細胞死は起こりにくいのですが、血管新生が起こらず、骨髄由来抑制細胞(MDSC)と制御性T細胞(Treg)の活性は抑制され、細胞傷害性T細胞(CTL)やナチュラルキラー(NK)細胞は抑制されないので、抗原特異的な抗腫瘍免疫を活性化することができます。
つまり、低用量のメトロノミック投与は、最大耐用量を投与する通常の抗がん剤治療とは異なるメカニズムで腫瘍縮小効果を発揮します。 しかも、免疫記憶が成立するので、再発を予防できることになります。 低用量頻回(メトロノミック)あるいは間歇的なシクロホスファミド投与と、樹状細胞の活性化による自然免疫の発動(イミキモド、ピドチモド)と、抗原特異的な細胞傷害性T細胞の活性化をサポートする方法(COX-2阻害剤、シメチジン、漢方薬など)を組み合わせると、免疫機序での腫瘍の排除ができる可能性があります。
図:シクロホスファミドは高用量でがん細胞の免疫原性細胞死を引き起こすが、低用量では細胞死は誘導できない(①)。腫瘍組織の血管新生は低用量で阻害されるが、高用量では、細胞死によって産生されるサイトカインや増殖因子によってむしろ促進される(②)。T細胞の働きを抑制する骨髄由来抑制細胞(MDSC)と制御性T細胞(Treg)はシクロホスファミドの低用量で活性が抑制され、高用量でも細胞死によって活性が抑制される(③)。低用量ではMDSCとTregの活性低下によって、細胞傷害性T細胞(CTL)とナチュラルキラー細胞(NK細胞)の活性は亢進するが、高用量では細胞死によって抑制される(④)。
まとめ:。低用量のシクロホスファミド((50mg/日を週1~2回))は抗腫瘍免疫を活性化する。
◉ COX-2阻害剤のセレコキシブは骨髄由来抑制細胞を抑制する
免疫抑制性の細胞は、免疫反応を適切な時期に終息させたり、自己のタンパク質や食物に反応しないようにする働きがあります。もし異常に免疫系が活性化され続けたり、自己のタンパク質と反応すると、自己免疫疾患やアレルギー性疾患を引き起こします。 つまり、免疫応答を実行する細胞が暴走しないように抑制性の細胞やサイトカインや伝達物質が存在し、それによって免疫系が正常に働くことができるのです。
免疫抑制のメカニズムの一つに骨髄由来抑制細胞(Myeloid derived suppressor cell: MDSC)があります。この細胞は顆粒球のマーカーと単球/マクロファージのマーカーとを同時に発現している未熟な段階の骨髄由来細胞で、免疫反応を強力に抑制する働きを持っています。 骨髄由来抑制細胞はアルギナーゼや活性酸素、一酸化窒素、IL-10、TGF-βなどの産生を介して免疫担当細胞の活性を阻害したり、制御性T細胞(Treg)の誘導をきたすことによって免疫抑制作用を発揮します。
正常な場合には、免疫系が過剰に働いて自らの体を攻撃してしまう自己免疫疾患にならないように、骨髄由来抑制細胞や制御性T細胞がブレーキをかけています。つまりこれらの免疫抑制細胞は、健康な人にとっては、むしろ良い働きを担っています。
一方、担がん(体内にがんがある)状態では、骨髄由来抑制細胞ががん病巣部位のみならず循環血中やリンパ組織(リンパ節や脾臓など)においても増加することが報告されています。 末梢血中の骨髄由来抑制細胞の数が多いと予後が悪いという報告もあります。
がん細胞は免疫抑制性の骨髄由来抑制細胞をがん組織内に動員させることによって、キラーT細胞やNK細胞からの攻撃を抑えていることが明らかになっています。 つまり、がん細胞を攻撃・排除しようとするナチュラルキラー細胞(NK細胞)や細胞傷害性T細胞(キラーT細胞)の働きが、がん組織内では骨髄由来抑制細胞の増加によって抑制されているのです。
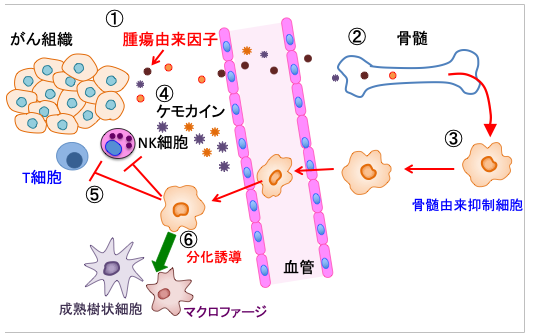
図:腫瘍組織からプロスタグランジンE2、IL-6、TGF-β、VEGF、GM−CSFなどの因子が産生される(①)。これらの腫瘍由来因子は血流によって骨髄に達し(②)、骨髄の前駆細胞から骨髄由来抑制細胞(MDSC)の増殖を促進する(③)。腫瘍組織から産生されるケモカイン(CXCL1/2やCXCL12など)がMDSCを腫瘍組織に誘導して集める(④)。腫瘍組織に集まったMDSCは細胞傷害性T細胞(CD8+T細胞)やナチュラルキラー細胞(NK細胞)の働きを阻害して抗腫瘍免疫を抑制する(⑤)。MDSCは成熟した樹状細胞やマクロファージに分化させることもできる(⑥)。
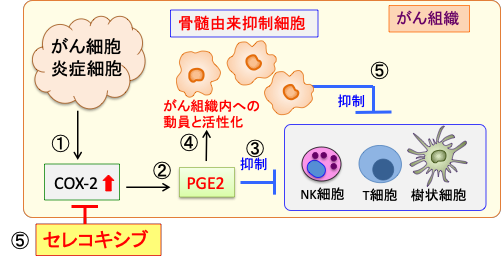
がん組織ではがん細胞やマクロファージが産生するシクロオキシゲナーゼ-2(COX-2)の活性亢進によってプロスタグランジンE2(PGE2)の産生が高まっています。 PGE2ががん組織に骨髄由来免疫抑制細胞を動員し、免疫担当細胞の働きを弱めることによって、免疫細胞の攻撃からがん細胞を守っていることが明らかになっています。 COX-2阻害剤のセレコキシブ(celecoxib)が骨髄由来抑制細胞の働きを阻害して、免疫療法の効き目を高めることが報告されています。
図:がん組織内ではがん細胞と炎症細胞からのシクロオキシゲナーゼ-2(COX-2)の発現と活性が亢進している(①)。COX-2はプロスタグランジンE2(PGE2)の産生を増やし(②)、PGE2は免疫担当細胞(樹状細胞、リンパ球、NK細胞など)の働きを抑制する(③)。一方、PGE2は骨髄由来抑制細胞を動員しがん組織内で増え、活性化する(④)。この骨髄由来抑制細胞は免疫担当細胞の働きを抑制する(⑤)。セレコキシブはCOX-2活性を阻害することによって、抗腫瘍免疫を活性化する。
まとめ:骨髄由来抑制細胞を誘導するプロスタグランジンE2の産生を抑制するCOX-2阻害剤のセレコキシブ(celecoxib)を1日200~400mg服用(朝と夕の食後)
◉ シメチジンは多彩な機序で抗腫瘍作用を発揮する
1980 年代後半に デンマークのTonnesen らにより、シメチジンが胃がん患者に対し延命効果を示すことが報告され、その後、大腸がん、悪性黒色腫に対しても同様の効果を示すことが報告されています。 例えば、治癒切除術後5-FU(200mg/日)投与を受けている原発性大腸がん患者(シメチジン800mg/日併用群34例、非併用群30例の計64例)において、平均10.7年の観察期間での10年生存率は、シメチジン併用群で84.6%、シメチジン非併用群で49.8%でした(P<00001)。
切除手術を受けた大腸がん患者を対象にした臨床試験のメタ解析によると、シメチジンを服用することによって死亡リスクが0.53に低下すると報告されています。
ヒスタミンにはがん細胞の増殖を促進する作用や、細胞性免疫を抑制するリンパ球(骨髄由来抑制細胞や制御性T細胞)を活性化することなどが報告されており、そのためシメチジンの延命効果は、がん細胞に対するヒスタミンの細胞増殖促進作用を阻害する機序や、がん細胞に対する免疫力を活性化させ る可能性などが指摘されています。
さらに近年では、シメチジンが接着因子 E-セレクチンの発現を抑 制することによりがんの転移を抑制する抑える機序や、インターロイキン 12の発現上昇を介したナチュラルキラー細胞活性化、血管新生阻害作用によって腫瘍組織の増大を阻止する可能性、がん細胞にアポトーシス(細胞死)を誘導する作用など、新たなメカニズムも報告されています。 シメチジンには様々なメカニズムで抗腫瘍免疫を増強することが報告されています。以下のような作用機序が報告されています。○ 抗腫瘍免疫(Th1)の増強:
生体の免疫機構は細胞性免疫型(Th1)と体液性免疫型(Th2)のバランスにより制御されていますが、多くのがん患者や担がん状態の実験動物においてその免疫機構が Th2 型へ移行していることが報告されています。 がん細胞の排除には細胞性免疫(Th1細胞)が中心的な役割を担うと考えられていることから、Th2 型への移行は担がん宿主の免疫機能低下の一因であると考えられています。 免疫機構が Th2 型に移行している担がんマウスに IL-12 を投与すると腫瘍の顕著な退縮が認められることが数多く報告されています。
IL-12 はナチュラルキラー細胞や T 細胞をその傷害活性の誘導・増強に向けて活性化するのみでなく、生体の細胞性免疫を促進する根源的な役割を担うサイトカインです。 IL-12 の主な産生細胞 はマクロファージおよび B 細胞であることが知られていますが、近年マクロファージからの IL-12 産生をヒスタミンが抑制すること、またその抑制作用はヒスタミン H2 受容体拮抗薬を前処置した際には認められないことが報告されています。
多くのがん組織においてはヒスタミン含量の上昇や、ヒスタミン合成酵素であるヒスチジンデカルボキシラーゼ活性の上昇が確認されています。これらのことは、担がん状態における免疫機構の Th2 型への移行原因の一つに、上昇したヒスタミンに よるマクロファージからの IL-12 産生抑制が関与している可能性を示唆するものです。 したがって、ヒスタミンH2受容体拮抗薬は、IL-12の産生を高め、細胞性免疫(Th1細胞)の活性を高める効果が期待できます。○ 樹状細胞の活性化:
がん細胞に対する免疫応答の中でがん抗原に対する免疫応答誘導において鍵となる細胞である樹状細胞の抗原提示能を増強させる可能性が報告されています。○ ナチュラルキラー細胞の活性化:
インターロイキン12(IL-12)の発現を亢進してナチュラルキラー細胞活性を高める効果が報告されています。インターロイキン-12(IL-12)は、当初"NK細胞刺激因子"の名称で報告されたように、NK細胞に対する著明な活性化作用を特徴とするサイトカインです。 IL-12はB細胞および単球系細胞より産生され、T細胞やNK細胞に対して細胞増殖の促進、細胞傷害活性誘導、IFN-γ産生誘導、LAK細胞誘導などの作用を示します。こうした細胞性免疫機能への作用から、IL-12には感染防御やがん治療や免疫不全症の改善における臨床応用が期待されています。 前述のごとく、ヒスタミンはIL-12 の産生を抑制するので、シメチジンはIL-12の産生を高めてナチュラルキラー細胞活性を高める効果を発揮します。○ 細胞傷害性Tリンパ球の活性化:
ヒスタミンには細胞傷害性Tリンパ球の生成を抑制する作用が知られています。さらにヒスタミンH2受容体はサプレッサーT細胞にも発現が認められ、ヒスタミンによりサプレッサーT細胞が活性化され、宿主側の免疫システムを減弱させると報告されています。そこでヒスタミンH2受容体拮抗薬が上記のヒスタミンの作用を抑制し、免疫システムを増強し、抗腫瘍作用を示すのではないかと推測されています。 また、抗腫瘍免疫の働きを弱める骨髄由来抑制細胞や制御性T細胞の働きをヒスタミンが高めるので、抗腫瘍免疫が抑制されるという報告もあります。
シメチジン投与群では腫瘍組織にリンパ球の浸潤が多く見られたという報告があります。 このような腫瘍組織に浸潤するリンパ球の存在は、腫瘍に対する宿主の免疫応答を意味しており、予後が良いことを示すサインと言えます。つまり、シメチジンはがん組織に対する免疫応答(細胞性免疫)を増強する効果があると言えます。 大腸がんはヒスタミンを分泌し、がん組織の中のヒスタミンのレベルが高いことが報告されています。つまり、がん患者や手術後の病態における免疫抑制には、ヒスタミンが関与している可能性があり、H2ブロッカーによって、免疫力低下の機序を解除できる可能性が指摘されています。まとめ:シメチジンを1日400mgから800mg(朝食後と就寝前)を服用する。
◉ プロパゲルマニウムは抗腫瘍免疫を増強する
プロパゲルマニウムはB型慢性肝炎の治療に使用されている経口薬です。商品名はセロシオンで、1994年に承認されてから使われている既存薬です。
プロパゲルマニウムは、IL-1、IL-2、IFN-γ産生増強などによって細胞傷害性T細胞(キラーT細胞)、NK細胞を賦活化します。CCL2/CCR2経路を阻害しがん細胞の転移を抑制することが報告されています。
がん組織からCCL2というケモカインが分泌されています。ケモカインはサイトカインの一種で、白血球などの遊走を引き起こすタンパク質です。
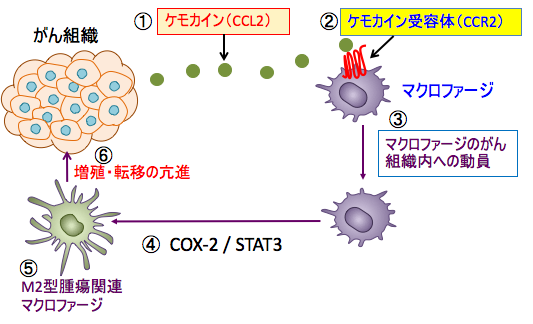
CCL2は別名を単球走化性タンパク質-1と言い、創傷部位やがん組織にマクロファージや単球を動員する作用があります。がん組織に動員された腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によってM2型の腫瘍関連マクロファージになり、がん細胞の増殖や転移を促進します。(下図)
図:がん細胞からケモカインのCCL2が分泌され(①)、マクロファージのケモカイン受容体のCCR2に結合すると(②)、マクロファージはがん組織へと誘引され、腫瘍関連マクロファージとしてがん細胞の増殖を助ける(③)。腫瘍関連マクロファージはシクロオキシゲナーゼ-2(COX-2)から産生されるプロスタグランジンE2や、シグナル伝達兼転写活性化因子3(STAT3)の活性化によって(④)M2型の腫瘍関連マクロファージになり(⑤)、がん細胞の増殖や転移を促進する(⑥)。
がん組織内や周囲にいる線維芽細胞から、CCL2と呼ばれるタンパク質が過剰に分泌されて、がん細胞の周りに単球細胞(マクロファージ)を異常に呼び寄せています。 プロパゲルマニウムはCCL2の働きを阻害します。
九州大学生体防御医学研究所の中山敬一教授らの研究グループは、プロパゲルマニウムをマウスに投与したところ、単球細胞の集積がみられなくなり、転移先でのがん細胞の増殖が抑えられることを報告しています。
プロパゲルマニウム治療で進行がんが消滅する例も報告されています。以下のような報告があります。Propagermanium Induces NK Cell Maturation and Tends to Prolong Overall Survival of Patients With Refractory Cancer(プロパゲルマニウムはNK細胞の成熟を誘導し、難治性がん患者の全生存期間を延長する傾向がある)Anticancer Res . 2019 Sep;39(9):4687-4698.
この研究では、難治性の口腔がん(8例)と胃がん(15例)の患者がプロパゲルマニウム(30mg/
日)を投与されました。プロパゲルマニウムの投与はナチュラルキラー細胞(NK細胞)の成熟を促進し、がん細胞のアポトーシスが増加しました。胃がん患者の全生存期間の中央値は172日で、2人の患者は肺または肝臓の転移が消滅しました。口腔がん患者の生存期間も延長する傾向が認められました。
まとめ:プロパゲルマニウムは細胞傷害性T細胞(キラーT細胞)やNK細胞を活性化し、抗腫瘍免疫を増強してがん細胞を死滅する効果がある。
◉ ドコサヘキサエン酸は炎症を抑え、悪液質を改善する
炎症反応(CRP)が高く、体重減少や食欲低下が顕著ながん性悪液質の状態では、免疫活性化は、炎症を促進して病状を悪化させることがある。炎症が強いときには、むしろ抗炎症作用とがん性悪液質を改善する効果を持ったドコサヘキサエン酸が有効です。
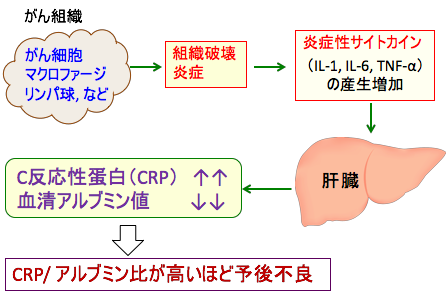
C-反応性蛋白(C-reactive protein=CRP)とは、体内に炎症が起きたり、組織の一部が壊れたりした場合に、血液中に現れる蛋白質の一種です。 CRPは炎症に対する生体反応として肝臓から産生されます。細菌感染症や自己免疫疾患(膠原病)、心筋梗塞、肝硬変、悪性腫瘍などにおいて、炎症や組織破壊の程度が大きいほど高値になり、炎症や破壊がおさまってくるとすみやかに減少します。そのため病気の活動度や重症度、あるいは病気の予後を知る指標として使われています。
手術後のがん患者や手術不能のがん患者などを対象に、CRPの血中濃度と予後との関連を検討した報告は多数あり、CRPの血中濃度とがんの進行度やがん患者の予後不良とは正の相関があることが示されています。すなわち、CRPが高いほど、予後が悪い(生存期間が短い)ことが多くの研究で明らかになっています。
図:がん組織が増大し周囲に浸潤したり他の臓器に転移を起こして、組織の破壊や炎症反応が起こると、生体反応として肝臓からC-反応性蛋白(CRP)が産生される。血中のCRP値が高いほど、組織破壊や炎症が高いことを示唆している。炎症性サイトカインは肝臓におけるアルブミン産生を抑制する。その結果、CRP/アルブミンの比が高いほど、組織破壊や炎症が強いことを意味し、がん患者の予後が悪いことが報告されている。
CRPそのものは炎症の程度の指標ですが、CRPが高いということは炎症性サイトカインの産生が高い状態で、これはがん性悪液質の原因となり、その結果として低アルブミンや貧血の原因になります。つまり、CRP高値と低アルブミンは予後不良を意味します。
炎症性サイトカインの産生を抑える治療として、副腎皮質ホルモン、プロスタグランジンの産生を抑えるシクロオキシゲナーゼ阻害剤、TNF-アルファの産生を阻害するサリドマイドなどがあります。サプリメントとして魚の油のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)も有効です。
ドコサヘキサエン酸(DHA)は抗炎症作用によって悪液質を改善すると同時に、がん細胞の増殖を抑える作用もあります。
食事から摂取された脂肪は代謝されてエネルギー源となり、また分解されて生成した脂肪酸は細胞膜などに取り込まれます。
細胞膜の構成成分として使われる場合、その脂肪酸自体は変化せず、それぞれの構造や性質を保ったまま使われます。つまり、細胞膜をつくるとき脂肪酸の違いを区別せず、手当たり次第にあるものを使用するのです。その結果、食事中の脂肪酸の種類によって細胞の性質も変わってきます。
DHAやEPAを多く摂取するとがん細胞が抗がん剤で死にやすくなることも報告されています。その理由は、食事から摂取されたω3不飽和脂肪酸ががん細胞の膜の脂質組成を変えることによって細胞シグナル系に影響して増殖を抑えるからです。炎症はがんの悪化や進展や悪液質を促進します。DHAやEPAは、炎症を悪化させる因子(プロスタグランジンや炎症性サイトカインなど)の産生を抑制し、炎症を収束させる因子の産生を増やすことによって、がんの悪化や進展を抑制する効果、正常組織や臓器をダメージから保護する効果、体重減少や栄養状態の悪化を防ぐ効果、免疫力を高め感染症を予防する効果、外科手術後の合併症を予防する効果などが発揮します。
まとめ:進行がんの治療には1日3から5gのDHAの摂取が有効であることが多くの研究で示されています。 炎症反応(CRP)が高く、がん性悪液質の場合は、DHAを多めに摂取することは有効です。
◉ ニトロキソリンはBETファミリータンパク質を阻害する
ニトロキソリン(Nitroxoline)はヨーロッパやアジアやアフリカで50年以上前から使用されている抗生物質です。 経口摂取で消化管から効率よく吸収され、尿中に排泄され、尿中の濃度が高くなるので、尿路感染症に使用されています。
近年、ニトロキソリンは強力な抗腫瘍活性を持つことで注目されています。 血管新生阻害作用、アポトーシスの誘導、がん細胞の遊走や浸潤の阻害作用などが報告されています。 人間で、尿路感染症に使われる1日500mg〜750mgで十分な抗腫瘍効果が期待できます。
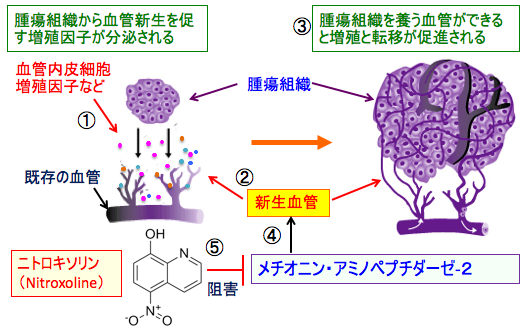
ニトロキソリンの抗がん作用のメカニズムの一つとして血管新生阻害作用が報告されています。 血管新生を阻害するターゲット物質としてメチオニン・アミノペプチダーゼ-2(methionine aminopeptidase-2:MetAP-2)が注目されています。 175,000種類の化合物をメチオニン・アミノペプチダーゼ-2の酵素活性の阻害活性でスクリーニングした結果、ニトロキソリンがメチオニン・アミノペプチダーゼ-2を強力に阻害する作用が見つかっています。 さらに、ヒト臍帯静脈血管内皮細胞を用いた研究でもニトロキソリンが血管新生を阻害する作用が報告されています。
図:がん組織から血管内皮細胞増殖因子(VEGF)などの血管新生を促進する増殖因子が分泌される(①)。 VEGFは血管内皮細胞の増殖や血管形成を促進して新生血管を作る(②)。腫瘍組織を養う血管が増えると増殖と転移が促進される(③)。メチオニン・アミノペプチダーゼ-2は内皮細胞の増殖や血管形成において重要な役割を担っている(④)。尿路感染症治療薬として古くから使用されているニトロキソリン(Nitroxoline)はメチオニン・アミノペプチダーゼ-2の活性を阻害することによって、血管新生を阻害し、がん細胞の増殖を抑制する(⑤)。
多くのがん細胞において、がん遺伝子や抗アポトーシスタンパク質(Bcl-2など)の発現上昇が確認されています。 BETファミリータンパク質は高アセチル化ヒストンへの結合を介して、がん遺伝子や抗アポトーシスタンパク質の発現を促進する作用があります。 ブロモドメイン(bromodomain)はヒストンのアセチル化リジンを認識し、制御タンパク質を集めてクロマチン構造や遺伝子発現を制御する機能が知られているタンパク質ドメインです。 ブロモドメイン繰り返し配列および特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質としてBRD2,BRD3,BRD4,BRDTが知られています。
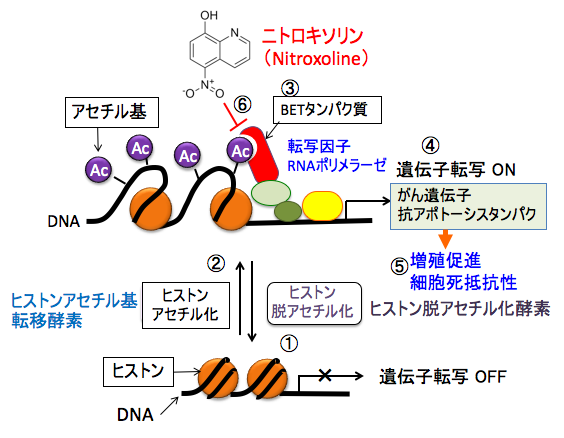
ヒストンのアセチル化リジンとBETファミリータンパク質のブロモドメインの結合を阻害する薬剤をがん細胞に投与すると、遺伝子発現パターンが正常細胞に近づくことが知られています。ヒストンとBETファミリータンパク質の結合を阻害する低分子化合物(BET阻害剤)の抗がん作用が注目されています。 ニトロキソリンがBETタンパク質を阻害することが報告されています。
図:ヒストン脱アセチル化酵素によってヒストンのアセチル化が低下するとクロマチンが凝集して遺伝子転写活性は抑制される(①)。ヒストンアセチル基転移酵素によってヒストンがアセチル化されるとクロマチンが緩み、遺伝子転写活性が亢進する(②)。ヒストンのアセチル化されたリジンを認識するブロモドメインの繰り返し配列と特異的末端配列を持つBET(bromodomain and extra-terminal)ファミリータンパク質(③)は、転写因子などをリクルートして、がん遺伝子や抗アポトーシスタンパク質の転写を活性化する(④)。その結果、がん細胞の増殖を促進する(⑤)。ニトロキソリンはアセチル化リジンとブロモドメインの結合を阻害する(⑥)。その結果、がん細胞の増殖を抑制し、細胞死を誘導する。
まとめ:ニトロキソリンは血管新生阻害作用とBETファミリータンパク質を阻害する作用がある。1日に250mgから750mgを服用する。
◉ c-Myc活性を阻害するとがん細胞は死滅する
多くのがん細胞でc-Myc遺伝子の過剰発現が起こっており、c-Mycはがん治療の重要なターゲットになっています。 現時点で、c-Mycの働き自体を直接阻害する薬はありませんが、c-Mycの発現レベルを阻害する方法は幾つかあります。c-Myc遺伝子の発現を抑制する治療法はがん治療に有効です。 実際に、c-Mycの不活性化はヒトがんの治療に有効であることが明らかになっています。 c-Mycの不活性化はリンパ腫、白血病、骨肉腫、肝臓がん、扁平上皮癌、すい臓がんなど多くのがん種に対して、増殖抑制、最終分化誘導、アポトーシス誘導、血管新生抑制など多彩な機序で抗腫瘍効果を示すことが報告されています。
上記で解説した薬のうち、メベンダゾール、イベルメクチン、メトホルミン、ビタミンD3、ドコサヘキサエン酸、ニトロキソリンはc-Myc遺伝子の転写を異なるメカニズムで阻害するので、相乗効果が期待できます。以下のサイトで解説しています。
c-Mycをターゲットにしたがん治療
◉ 再利用薬を用いたメトロノミック化学療法と免疫療法の具体的方法
標準治療のがん化学療法は、がん細胞を死滅させることを主な目的とするため、副作用が耐えられる最大耐用量の抗がん剤を投与します。この方法が奏功する場合もあります。しかし、この方法(最大耐用量の化学療法)で効果が出なくなった場合は、がん細胞を死滅することに固執するのではなく、全く別のアプローチを考慮することも重要です。
『再利用薬を用いたメトロノミック化学療法と免疫療法 』 は腫瘍血管の増生阻害や抗腫瘍免疫の活性化などによってがん組織の増大を阻止し、長期的ながん縮小あるいはがんとの共存を目指す治療法です。 副作用は少なく、しかも古くから他の病気の治療に用いられている薬を再利用するため、比較的安価で実施できます。メトロノミック・ケモテラピーや免疫増強法に関するご質問やご相談はメール(info@f-gtc.or.jp)か電話(03-5550-3552)でご連絡ください。