カンナビジオールは抗がん剤の副作用を軽減する
カンナビジオールはパクリタキセルの神経性疼痛を軽減する
Cannabidiol inhibits paclitaxel-induced neuropathic pain through 5-HT(1A) receptors without diminishing nervous system function or chemotherapy efficacy. (カンナビジオールは、神経系の機能や抗がん剤の効果を減弱することなく、5HT1A受容体を介してパクリタキセル誘発性の神経性疼痛を阻止する)Br J Pharmacol. 171(3):636-45.2014年
【要旨】
研究の背景と目的:パクリタキセルは末梢神経にダメージを与えて痛みを引き起こす副作用があり、これによって抗がん剤治療を中断せざるを得ない場合もある。我々は以前の研究において、精神変容作用を持たないカンアビノイド(大麻に含まれるある種の成分の総称)の一つであるカンナビジオールが、パクリタキセルによる機械的および温熱による疼痛感受性の亢進を阻止する作用を有することをマウスを使った実験で明らかにした。 抗がん剤による末梢神経障害を阻害するカンナビジオールの作用のメカニズムを明らかにし、カンナビジオールの作用が神経機能や抗がん剤の抗腫瘍効果を減弱させる作用がないかどうかを検討した。
主な結果:マウス(C57Bl/6 mice)を使った実験で、パクリタキセルで誘発される機械的刺激に対する疼痛感受性の亢進はカンナビジオール(2.5~10mg/体重1kg)の投与によって阻止された。この効果は5−HT(1A)受容体のアンタゴニスト(拮抗薬、阻害薬)であるWAY100635の同時投与によって減弱したが、カンナビノイド受容体のCB1のアンタゴニスト(SR141716)やCB2のアンタゴニスト(SR144528)では減弱しなかった。カンナビジオールの投与によってマウスの学習機能や認知機能などに低下は認めなかった。 培養乳がん細胞を用いた実験では、パクリタキセルとカンナビジオールの併用は、相加あるいは相乗的な抗腫瘍効果の増強を示した。
結論:今回の実験結果より、カンナビジオールはパクリタキセルによって引き起こされる神経障害を予防する効果を示し、その作用機序として5-HT1A受容体を介する機序が示唆された。さらに、学習効果や認知機能などの神経系の働きに悪影響は及ぼさず、乳がん細胞に対するパクリタキセルの抗腫瘍効果を減弱させることはなかった。
以上のことから、パクリタキセルによる抗がん剤治療にカンナビジオールを併用することは、神経障害の発生予防や軽減において有効で安全な治療法と言える。パクリタキセルなどの抗がん剤治療における末梢神経障害(しびれ、感覚異常、味覚障害、疼痛など)によって苦しむ患者さんは極めて多くいます。しかも、有効な治療法がありません。ビタミン剤(ビタミンB6,B12など)や漢方薬(牛車腎気丸や芍薬甘草湯など)やリリカやサプリメント(アセチル-L-カルニチン、メラトニン、αリポ酸、DHA/EPAなど)など多くの方法が多少の効果が報告されていますが、現実的には強い神経障害に対してはあまり効いていません。
カンナビジオールは直接的な抗がん作用が報告されています。
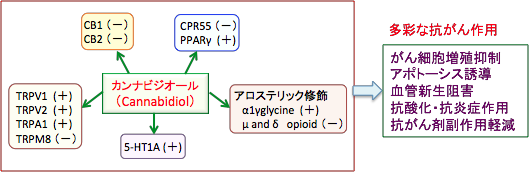
カンナビジオールはカンナビノイド受容体のCB1とCB2には作用しませんが、Ca透過性イオンチャネルのTRPV(transient receptor potential vanilloid type)やセロトニン受容体の5-HT1Aなど幾つかの受容体に作用することが報告されています。(下図参照)
図:カンナビジオールは様々な受容体に作用して、その働きに影響する。図内の(+)はその受容体にアゴニスト(作動薬)として作用して受容体を刺激する。(−)は拮抗的あるいは阻害的に作用してその受容体の働きを抑制する。内因性カンナビノイドの受容体であるCB1/CB2のアゴニスト(作動薬)に対してカンナビジオールは拮抗作用を示す。さらに、カンナビジオールはCB1とCB2に対して逆アゴニストとして働き、CB1/CB2受容体の働きを阻害する。カンナビジオールはセロトニン受容体の5-HT1A受容体とTRPV1-2バニロイド受容体を活性化する。その他にも様々な受容体やタンパク質と作用して活性化や阻害の作用を示し、これらの総合的な作用によって多彩なメカニズムで抗がん作用を発揮する。(図はBr J Clin Pharmacol 75(2):303-312, 2012年のFigure 2より改変)
この論文では、5-HT1A受容体の拮抗薬によってカンナビジオールの神経障害抑制効果が減弱(阻止)されたので、カンナビジオールの神経障害抑制作用はこの5-HT1A受容体の関与を示唆しています。
5-HT1A受容体はセロトニン受容体の一種で、5-HT1A作動薬は抗不安や抗うつ作用などの作用があります。7回膜貫通型のG蛋白共役型受容体で、アデニル酸シクラーゼ活性の抑制や、内向き整流性カリウムチャネルを活性化して神経活動を抑制(過分極)することが知られています。
5-HT1A受容体は不安障害やうつ病の治療標的分子として長く研究されてきましたが、最近の研究によって統合失調症やパーキンソン病の新たな治療ターゲットとしても注目されるようになってきました。実際にカンナビジオールが統合失調症など精神疾患に有効であることが報告されています。 このような作用から、抗がん剤による末梢神経障害による痛みや感覚異常やしびれに対する効果が得られるのかもしれません。
カンナビジオールはシスプラチンの副作用を軽減する
Cannabidiol Attenuates Cisplatin-Induced Nephrotoxicity by Decreasing Oxidative/Nitrosative Stress, Inflammation, and Cell Death.(カンナビジオールは活性酸素や一酸化窒素によるストレス、炎症および細胞死を減少させることによってシスプラチンによる腎障害を軽減する)J Pharmacol Exp Ther.328(3): 708–714.2009年
シスプラチンは腎毒性の発現頻度が高い抗がん剤です。シスプラチンは静脈内投与後に血漿蛋白と結合しますが、蛋白と結合しなかったフリーのシスプラチンは腎臓の糸球体からろ過され、近位尿細管に蓄積されます。シスプラチンの腎毒性は、このフリーのシスプラチンが近位尿細管細胞に酸化ストレスを与え、細胞死を誘導することが主な原因です。腎毒性を減少させるには、尿中のシスプラチン濃度を低下させ、近位尿細管の細胞との接触時間を減らすことが重要で、そのため水分負荷と強制利尿が行われています。
シスプラチンによる細胞傷害には、活性酸素や一酸化窒素の産生が高まって細胞に酸化ストレスを与え、炎症反応や細胞死が引き起こされることによって生じます。
この論文では、マウスにシスプラチンを投与して腎障害を引き起こす実験モデルを用いて、カンナビジオールが活性酸素や一酸化窒素などのフリーラジカルの産生を抑制し、タンパク質やDNAのダメージや炎症を抑制することによって腎臓における細胞傷害を軽減する効果を報告しています。
カンナビジオールは吐き気を軽減する
医学用語では吐き気を「悪心(おしん)」、吐くことを「嘔吐(おうと)」と言います。
抗がん剤治療を受けた患者さんで、予期性悪心や予期性嘔吐を呈する人がいます。 これは、抗がん剤治療時の副作用として吐き気を経験した人の中で、実際に抗がん剤の投与を受けていない時でも、抗がん剤治療を想像しただけで、吐き気を感じてしまったり、実際に嘔吐してしまうような症状を予期性悪心や予期性嘔吐と言います。他人の点滴をみたり、病院の建物を見ただけで、吐き気や嘔吐することもあります。
予期性悪心・嘔吐には普通の吐き気止め(制吐薬)はあまり効果がないとされ、抗不安薬が用いられています。カンアビジオールには抗不安作用があるので、予期性悪心や予期性嘔吐に効く可能性があります。実際に動物実験でカンナビジオールが抗がん剤治療に伴う予期性悪心や予期性嘔吐を予防する効果が報告されています。The effect of cannabidiol and URB597 on conditioned gaping (a model of nausea) elicited by a lithium-paired context in the rat.(ラットにおけるリチウム誘発性の条件づけギャッピングモデル[吐き気のモデル]に対するカンナビジオールとURB597の効果)Psychopharmacology 196(3): 389-395, 2008年
Gaping(ギャッピング)というのは「大口を開けること」で吐き気を意味する行動のようです。塩化リチウムを注射すると吐き気(悪心)が起こり、このときのラットの変化が「gaping:大口を開けること」です。この塩化リチウムを注射すると同時に匂いのついた場所に移すという条件付けを繰り返すと、塩化リチウムを投与しなくても匂いのついた場所に移すだけで悪心(吐き気)を起こすようになります。これが予期性悪心や予期性嘔吐の実験モデルとなります。この論文の要旨は以下です。
【要旨】
研究の背景:抗がん剤治療中の患者にしばしば経験される予期性悪心(Anticipatory nausea)は通常の吐き気止めを使った治療に抵抗性である。この研究では、予期性悪心に治療における内因性カンナビノイド系の制御の役割についてラットの悪心モデル(conditioned gaping)を用いて検討した。
目的:カンナビジオール(CBD)と脂肪酸アミド加水分解酵素(fatty acid amide hydrolase;FAAH)の阻害剤であるURB597(URB) がラットにおける条件付けギャッピングを減らすことができるかどうかを検討した。(脂肪酸アミド加水分解酵素は内因性カンナビノイドのアナンダミドを分解する酵素)
方法:匂いのついた場所にラットを起き、その直前に塩化リチウムの注射によって悪心を誘発しで条件付けを行った。1,5,10mg/kgのCBDはラットを匂いのついた場所に移す30分前に投与した。URBは0.1 か 0.3 mg/kgの用量を2時間前に投与した。 また、カンナビノイド受容体CB1のアンタゴニスト/逆アゴニスト(inverse agonist)であるSR141716Aの作用を検討した。
結果:予期性悪心を誘発する前に、CBD (1 and 5, but not 10 mg/kg) あるいは URB (0.3, but not 0.1 mg/kg)を投与すると条件付けギャッピングを抑制した。URBによる抑制効果はCB1のアンタゴニスト/逆アゴニストであるSR141716Aで前投与すると消失した。条件付けを行うとき、URBはその条件付けの成立を阻害した。
結論:内因性カンナビノイド系を制御することは予期性悪心の治療に効果が期待できる。この論文では、内因性カンナビノイドのアナンダミドを分解する脂肪酸アミド加水分解酵素の阻害剤(URB597)が予期性悪心を予防するということは、カンナビノイド受容体CB1の活性化が予期性悪心を予防する効果があることを意味しています。
URBによる抑制効果はCB1のアンタゴニスト/逆アゴニストを前投与すると消失したこともCB1の活性化が予期性悪心の予防の作用機序であることを意味しています。
カンナビジオールはCB1のアンタゴニスト/逆アゴニストとして作用するので、カンナビジオールの予期性悪心の予防の作用機序はCB1を介するものとは異なると考えられます。
カンナビジオールにはヒスタミン受容体5-HT1A受容体を活性化する作用があり、この作用は抗不安作用や吐き気止め作用があります。したがって、カンナビジオールは5-HT1A受容体を介する機序で吐き気を止める可能性が高いかもしれません。
ただし、カンナビジオールの作用機序は不明な点も多くあります。論文の中にはカンナビジオールがCB1受容体のアゴニストに分類しているものもあります。また、アナンダミドの分解に関与するfatty amide hydrolase (FAAH)の活性を刺激する場合と阻害する場合があります。 したがって、作用機序に関してはまだ不明な点が多いのですが、カンナビジオールには予期性悪心や予期性嘔吐の予防効果はあるということです。(カンナビジオールの抗不安作用や抗うつ作用や抗精神病作用は多くの論文で示されています。)
カンナビジオールはドキソルビシンの心臓毒性を軽減する
Cannabidiol Protects against Doxorubicin-Induced Cardiomyopathy by Modulating Mitochondrial Function and Biogenesis(カンナビジオールはミトコンドリアの機能と新生を制御することによってドキソルビシン誘発性心筋障害を防ぐ)Mol Med. 21(1): 38–45. 2015年
【要旨】
ドキソルビシンは広く使用されている抗腫瘍活性の高い抗がん剤であるが、その用量依存的な心臓毒性によって臨床使用に限界がある。ドキソルビシンの心臓毒性には活性酸素や一酸化窒素による酸化ストレスの亢進や、心筋細胞や血管内皮細胞のミトコンドリア機能の障害や細胞死が関与している。
カンナビジオールは大麻に含まれる精神活性を持たない成分であり、有害作用は少なく、抗酸化作用や抗炎症作用を有し、さらに最近は抗腫瘍活性も報告されている。
ドキソルビシン誘発性の心筋障害のマウスの実験モデルを用いて、カンナビジオールの効果を検討した。 ドキソルビシン誘発性心筋障害は心筋細胞のダメージのレベル(血清中のクレアチニンキナーゼと乳酸脱水素酵素の値)、活性酸素や一酸化窒素による細胞傷害のレベル(細胞内のグルタチオン量、グルタチオンペルオキシダーゼ1活性、脂質過酸化、3-ニトロチロシン形成、誘導性一酸化窒素合成酵素mRNAレベル)、心筋細胞死(アポトーシス、ポリADPリボースポリメラーゼ1依存性)、心筋機能(心拍出機能と左室内径短縮率)で評価した。 ドキソルビシンはミトコンドリア新生を抑制し、ミトコンドリア機能を低下させ(呼吸酵素複合体IとIIの活性低下)、心筋細胞における脱共役たんぱく2と3(uncoupling protein 2 and 3)とmedium-chain acyl-CoA dehydrogenase mRNAの発現を低下させた。
カンナビジオールの投与は、これらのドキソルビシン誘発性の心筋機能の障害を改善し、活性酸素や一酸化窒素による細胞ストレスと細胞死を軽減した。 カンナビジオールは障害されたミトコンドリア機能をミトコンドリア新生を改善した。 これらの実験結果は、ドキソルビシンによる心筋障害に対する新たな治療法をしてカンナビジオールの有用性を示唆しており、ミトコンドリアの機能や新生に対するカンナビジオールの作用は、他の多くの組織障害の実験モデルでのカンナビジオールの作用機序を説明できるかもしれない。心臓毒性を示す抗がん剤としては、ドキソルビシン(アドリアマイシン)などのアントラサイクリン系抗がん剤がよく知られています。 その他、シクロフォスファミド、5-フルオロウラシル、パクリタキセル、ハーセプチンなども心臓毒性の発現が報告されています。
ドキソルビシンによる心毒性は、1)投与後数時間以内に発現し、可逆性の不整脈などが主体の急性毒性、2)投与の数日後から数週間以内に発現する心筋炎や心外膜炎などの亜急性毒性、3)投与後数週間から数ヶ月以上して発現する慢性毒性の3種類に分類されます。
一般的には、ドキソルビシンの心臓毒性とは3)の慢性毒性を指し、心筋障害による致死的なうっ血性心不全を来すことが知られています。 この慢性毒性(心筋症)はドキソルビシンの総投与量が多くなるほど発症率が高まります。450mg/m2を超えると発現頻度が高くなり、1000mg/m2を超えると50%に達すると言われています。 うっ血性心不全を発現すると、利尿剤やジギタリス製剤などの治療に対する反応が悪く、死亡率が30~60%と極めて高いと言われています。 高齢者や心疾患を持っていたり、縦隔へ放射線照射との併用や、心臓毒性を持つ他の抗がん剤との併用の場合は、特に心臓毒性に対する注意が必要です。
したがって、ドキソルビシンやエピルビシンなどのアントラサイクリン系抗がん剤やハーセプチンや左胸部の放射線照射など心臓毒性を引き起こす治療中にカンナビジオールを併用することは心臓毒性による副作用の軽減に有効です。
(カンナビジオールの心臓毒性軽減作用のメカニズムについてはこちらへ:)
○ カンナビジオール・オイル(CBDオイル)についてはこちらへ