フェロトーシスをターゲットにした進行乳がんの治療
【がん細胞は鉄を多く取込んでいる】
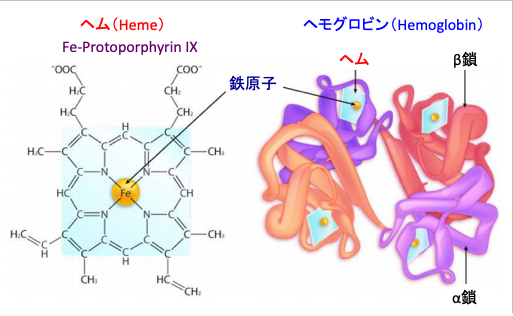
私たちの体内には、体重60kgで平均4g程度(2~6gくらい)の鉄が存在します。鉄は全て食事から体内に摂取しています。鉄は酸素などの小さな分子と強く特異的に結合する性質があります。体内の鉄の60%くらいはヘモグロビンのヘムとして存在し、酸素を運搬する働きを担っています。(図1)
図1:ヘモグロビンはα鎖とβ鎖と呼ばれる2種類のサブユニットから構成される四量体構造をしている。各サブユニットには1つのヘムが結合している。ヘム(Heme)は2価の鉄原子とポルフィリン(IX型プロトポルフィリン)から成る錯体で、赤血球中のヘモグロビンは、ヘムの鉄原子が酸素分子と結合することで酸素を運搬する。
鉄はイオンの価数が変化する遷移金属で、簡単に二価イオン(ferrous: Fe2+)と三価イオン(ferric : Fe3+)の両方の型を行き来するので、電子の移動を伴う生体反応に利用できます。
例えば、NADPHオキシダーゼ、キサンチンオキシダーゼ、リポキシゲナーゼ、チトクロームP450酵素など、活性酸素を産生させるような酵素の活性に必要です。ペルオキシソームで過酸化水素(H2O2)を分解するカタラーゼの活性にも鉄が必須です。
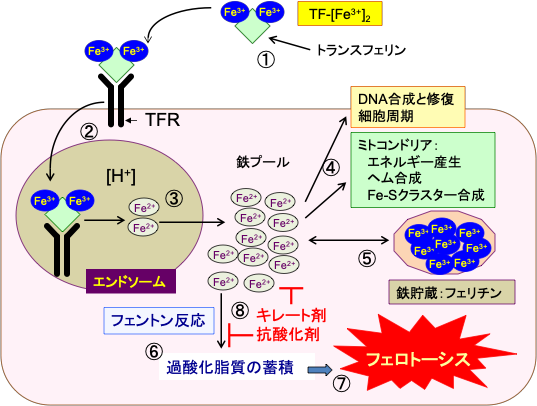
このように、鉄イオンは細胞の呼吸、核酸合成、増殖などに必須な補助因子として重要な役割を果たしています。したがって、がん細胞は鉄の需要が増え、鉄の取込みが増えています。血液中では鉄イオンはトランスフェリンに結合して細胞まで運ばれます。1つのトランスフェリンに2つの3価鉄(Fe3+)が結合します。 トランスフェリンは細胞膜にあるトランスフェリン受容体と結合し,エンドサイトーシスによって取り込まれ、リソソーム内で酸性の環境になると鉄イオンが解離し、2価の鉄(Fe2+)になって細胞内に取り込まれます。
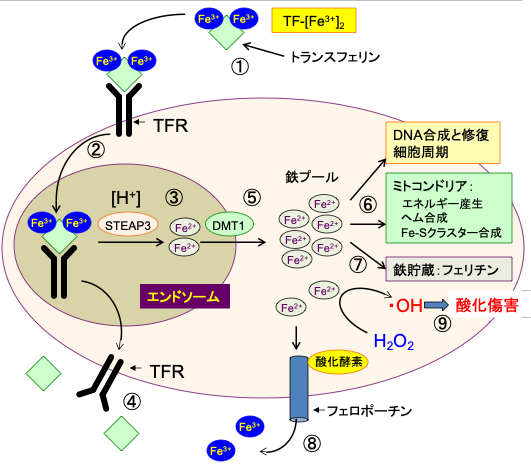
フリーの2価鉄イオンは鉄の利用の主要な器官であるミトコンドリアへの供給に必要な細胞質鉄プール(酸化還元活性のある不安定鉄プール)として蓄積され、DNA合成、細胞周期の制御、ミトコンドリアでのATP産生などに必須の働きを担っています。利用されない細胞質鉄プールのFe2+は、鉄を介した細胞の損傷を防ぐためフェリチンと結合して酸化還元反応を起こさない三価鉄(Fe3+)として貯蔵されるか、あるいはフェロポーチンにより細胞外に排出されます。 フェリチンは体内で鉄を貯蔵するタンパク質で、鉄とアポフェリチンによって構成され、多くの鉄イオンの周りをミセルで覆うことによって鉄を貯蔵します。(図2)
図2:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。ほとんどの細胞の細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシス (Endocytosis)によって細胞内に取り込まれる(②)。エンドソーム(endosome)内の酸性の環境では、鉄イオンはトランスフェリンから離れ、STEAP3の還元酵素活性(ferrireductase activity)によって3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。鉄が離れたトランスフェリンとトランスフェリン受容体は細胞膜に戻り、再利用される(④)。2価の鉄イオンは2価金属トランスポーター1(divalent metal transporter 1 :DMT1)を通ってエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)に入る(⑤)。鉄イオンは、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(⑥)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に貯蔵される(⑦)。鉄イオンは鉄排出ポンプであるフェロポーチン(ferroportin)によって細胞外に排出される(⑧)。この際、セルロプラスミン(ceruloplasmin)やヘフェスチン(hephaestin)のような酸化酵素によって2価の鉄イオンは3価に酸化され、トランスフェリンによって体内を運搬される。 細胞質の2価鉄イオンは過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシラジカル(・OH)を発生させ、細胞傷害を引き起こす(⑨)。したがって、鉄による細胞傷害を避けるためには、細胞内での鉄イオンの利用や貯蔵や排出の調節が極めて重要となる。
増殖活性の高いがん細胞は、細胞膜のトランスフェリン受容体の発現量が増え、正常細胞に比べて鉄の取込みが増えています。さらに、細胞内の鉄イオンの調節に破綻をきたし、酸化還元活性のあるフリーの2価鉄(Fe2+)が過剰に存在する状況になっています。
【2価鉄イオン(Fe2+)はフリーラジカルを発生して細胞を傷害する】
鉄は様々な生体反応に必須の物質ですが、過剰になると活性酸素発生の触媒作用を発揮することによって細胞の酸化傷害を引き起こします。 2価のフリーの鉄は過酸化水素(H2O2)と反応してより有毒なヒドロキシルラジカルを生じ(フェントン反応)、DNA障害、脂質酸化、細胞死などを引き起こします。
鉄は電子の授受を容易に行いうることから種々の酵素の活性中心として働いており,地球上のほぼすべての生物にとってその生存に必須な元素です。
しかし一方で,二価鉄(Fe2+)が過剰に存在すると,その高い反応性ゆえにフリーラジカルの産生を促進し細胞に対する傷害性をもたらすということです。
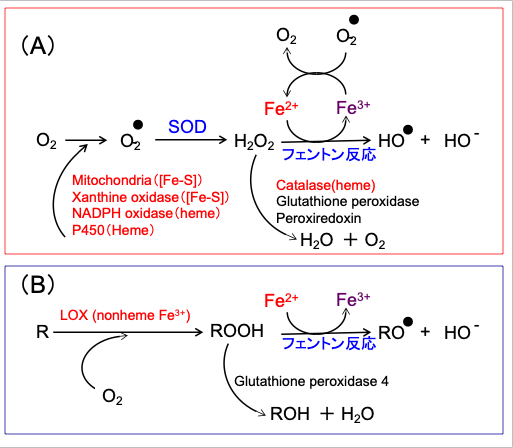
つまり、鉄は「両刃の剣」であり、鉄は不足しても過剰でも生体に悪影響を及ぼすため、生体においては鉄の量がつねに適切な量になるよう厳密に調節される必要があるのです。(図3)
図3:フェントン反応による過酸化水素(H2O2)からのヒドロキシラジカル(HO・)の産生(A)と脂質(ROOH)からの脂質ラジカル(RO・)の産生経路(B)。鉄イオンが関与する酵素は赤で示している。
慢性炎症組織やがん組織では、この鉄イオンの調節に破綻をきたし、フリーの2価鉄(Fe2+)が過剰に存在する状況になっています。この過剰鉄がフリーラジカルや活性酸素の産生を惹起して細胞毒として働き、細胞の老化やがん化を促進すると考えられています。
したがって、慢性炎症やがんの予防や治療における戦略としては、鉄イオンを減らす方法が考えられます。この方法として、瀉血や鉄のキレート剤の使用があります。このような方法で鉄を減らせば、慢性炎症やがんの発生や進行を抑えられると考えられています。
しかし一方、がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療が検討されています。
【鉄が介在する細胞死をフェロトーシスという】
前述のように、2価の鉄イオン(Fe2+)は、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)として存在しますが、このフリーの2価鉄は酸化還元活性があるので、過酸化水素(H2O2)と反応して酸化作用の強いヒドロキシルラジカル(・OH)を発生させ、さらに脂質と反応して脂質ラジカルを発生させて強い細胞傷害を引き起こします。
正常細胞に比べてがん細胞は、不安定鉄プールにおける2価鉄イオンの量が極めて多いので、2価鉄イオンと反応してヒドロキシルラジカルや脂質ラジカルを発生させる化合物は、正常細胞にダメージ(酸化傷害)を与えず、がん細胞に特異的にダメージを与えることができます。がん細胞内に過剰な2価鉄イオンが存在することを利用して、がん細胞を死滅させる治療が検討されています。鉄が関与するフェロトーシス(ferroprosis)という細胞死の存在とメカニズムが明らかになってきたからです。
細胞死のメカニズムとして,アポトーシス,ネクローシス,オートファジーなどが知られています。アポトーシス(Apoptosis)はミトコンドリアのチトクロームCやタンパク分解酵素のカスパーゼが関与する細胞死です。カスパーゼは、基質であるタンパク質をアスパラギン酸残基の後で切断するシステインプロテアーゼの総称です。アポトーシスの実行や炎症性サイトカインの活性化に関与するタンパク分解酵素です。
カスパーゼは初め不活性型の前駆体のプロ・カスパーゼ(pro-Caspase)として発現しますが、Fas などの細胞死受容体や各種の傷害刺激などに反応して速やかに切断され、活性型となります。
アポトーシスの過程においては、誘導型カスパーゼ(Initiator caspase)と実行型カスパーゼ(Executioner caspase/Effector caspase)に大別されます。
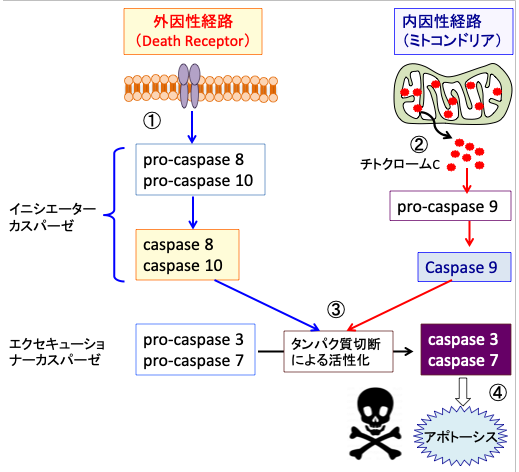
誘導型カスパーゼ(Caspase-2、8、9、10)は実行型カスパーゼ(Caspase-3、6、7)を切断・活性化することによりアポトーシスのシグナルをスタートさせます。実行型カスパーゼは、多くの細胞内タンパク質を分解し、アポトーシスの実行へと導きます(図4)。これらのカスパーゼの阻害剤はアポトーシスによる細胞死を阻止します。
図4:細胞死受容体(Fas と TNFR)のリガンド(FasLとTNF)による活性化(外因性経路)は、カスパーゼ8 および カスパーゼ10を活性化する(①)。ダメージを受けたミトコンドリアから放出されるシトクローム c はカスパーゼ-9 を活性化する(内因性経路②)。これらのカスパーゼはイニシエーターカスパーゼ(Initiator caspase)と呼ばれ、下流のエクセキューショナーカスパーゼ(Executioner caspase)のpro-caspase3とpro-caspase 7を切断して活性化する(③)。活性化したカスパーゼ3とカスパーゼ7は細胞内タンパク質を消化してアポトーシスを実行する(④)。
一方、脳梗塞や心筋梗塞の様な虚血や、火傷や毒物による細胞傷害では、壊死(ネクローシス)という細胞死を起こして、細胞が崩壊して炎症反応が引き起こされます。炎症反応を引き起こすことによって、生体に異常事態を知らせ、防御や修復を促進することができます。
オートファジー(autophagy)は細胞内の構成成分を分解するための細胞機能で、このオートファジーが関与するプログラム細胞死をオートファジー細胞死と呼んでいます。このように細胞はいろんなメカニズムや方法で死滅します。細胞死のメカニズムはこの3つだけではありません。最近、フェロトーシス(Ferroptosis)という細胞死が提唱されています。フェロトーシスでは、鉄依存的な活性酸素種の発生と過酸化した脂質の蓄積によって細胞死が起こります。
細胞内の鉄に依存する機構であり,ほかの金属類には依存しません。「フェロ(Ferro)」は「鉄」という意味です。カスパーゼ阻害剤はアポトーシスの細胞死を阻止できますが、フェロトーシスは阻止できません。
鉄に結合して反応性を阻害するキレート剤や、フリーラジカルを消去する抗酸化剤(ビタミンEなど)はフェロトーシスを阻止しますが、アポトーシスは阻止できません。
つまり、フェロトーシスは鉄のキレート剤や抗酸化剤で阻止され、カスパーゼ阻害剤では阻止できない点でアポトーシスと区別される細胞死です。(図5)
図5:鉄はトランスフェリンに結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。ほとんどの細胞の細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシス (Endocytosis)によって細胞内に取り込まれる(②)。エンドソーム(endosome)内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンはエンドソームを出て細胞質に移行し、細胞内の様々な機能に使用される不安定鉄プール(the labile iron pool)に入り、DNA合成に必要な酵素(リボヌクレオチド還元酵素など)の補因子、ヘム合成、鉄-イオウクラスターの形成など、細胞内の様々な目的で使用される(④)。余剰の鉄イオンは鉄貯蔵タンパク質のフェリチンの中に3価の鉄イオン(Fe3+)として貯蔵される(⑤)。細胞質の2価鉄イオンはフェントン反応によって酸化作用の強いヒドロキシルラジカルや脂質ラジカルを発生させ、過酸化脂質の蓄積を引き起こし(⑥)、フェロトーシスによる細胞死を誘導する(⑦)。鉄のキレート剤や抗酸化剤はフェロトーシスを阻害する(⑧)。
【アルテミシニン誘導体は抗マラリア薬として開発された】
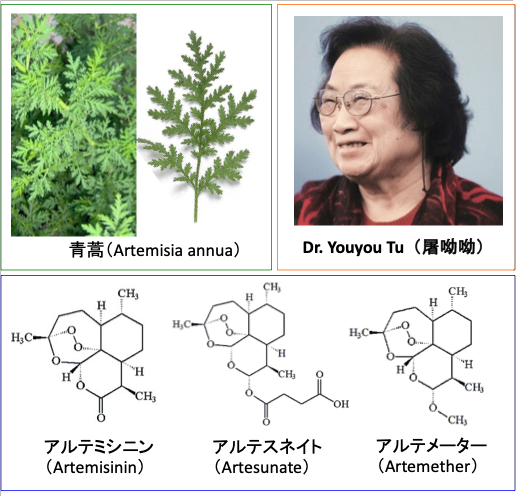
がん細胞にフェロトーシス(ferroptosis)を誘導する物質としてアルテミシン誘導体が近年注目されています。アルテミシニンは青蒿(セイコウ)というキク科の薬草から見つかっています。
青蒿(Artemisia annua)は中国伝統医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。抗マラリア作用の活性成分がアルテミシニン(Artemisinin)で、その効果を高めたアルテスネイト(Artesunate)とアルテメーター(Artemether)という2種類の誘導体が合成されています。これらは現在、マラリアの治療薬として世界中で使用されています。
青蒿からアルテミシニンを発見し、抗マラリア薬を開発した中国の女性科学者の屠呦呦(Tu Youyou)博士は、駆虫薬のイベルメクチンを開発した大村智氏およびW. C. キャンベル(William C. Campbell)氏と一緒に2015年のノーベル医学生理学賞を受賞しています。(図6)
図6:中国の女性科学者の屠呦呦(Tu Youyou)博士は、2011年のラスカー賞受賞に続いて、2015年度のノーベル医学生理学賞を受賞した。屠博士は、古くからマラリアの治療に利用されてきた青蒿(Artemisia annua)という薬草から活性成分としてアルテミシニン(Artemisinin)を発見した。アルテミシニンおよびその誘導体(アルテスネイト、アルテメーター)は、現在マラリアの治療薬として世界中で使用されている。さらに、抗がん作用があることから、がんの代替医療にも使用されている。
青蒿(セイコウ)という生薬は強力な解熱作用があり、中国医学でマラリアなど様々な感染症や炎症性性疾患の治療に古くから使用されていました。1972年に中国の湖南省長沙市の郊外で発掘された馬王堆漢墓は2100年以上前に作られた墓(古墳)ですが、その中から見つかった「五十二病方」という医書の中に、青蒿が記載されています。
青蒿はartemisia annuaという植物です。artemisiaとはヨモギのことで、青蒿はキク科ヨモギ属の植物です。 英語ではsweet Annieやwormwoodと呼ばれ、和名はクソニンジンとかカワラニンジンと呼ばれています。ベトコンを援助するために中国軍がベトナム戦争に従軍しましたが、密林でマラリアに感染して病死する兵士が多く、そこで毛沢東の命令でマラリヤの治療薬の開発が国家プロジェクトとして1967年に開始されました。その指揮を取ったのが、当時37歳の屠博士でした。 屠博士は1970年代に、その薬効成分のアルテミシニン(Artemisinin)を分離し、アルテミシニンやその誘導体のアルテスネイト(Artesunate)やアルテメーター(Artemether)の抗マラリア薬としての有効性を確認しました。
マラリアは、熱帯・亜熱帯地域の70ヶ国以上に分布し、全世界で年間3~5億人、死者は100~150万人と言われる感染症ですので、その治療薬としてのアルテスネイトなどのアルテミシニン誘導体の開発は、ある本では「伝統薬から開発された医薬品としては、20世紀後半における最大の業績」という表現がなされているほど、医学において重要な成果だと言われています。
近年、このアルテミシニン誘導体が抗がん物質として注目を集めています。
【アルテミシニンとその誘導体は正常細胞には毒性が少なく、がん細胞に抗がん作用を示す】
培養がん細胞を使った実験でアルテミシニンやアルテスネイトががん細胞を死滅させる作用や、がん細胞を移植した動物実験で、がんを縮小させる効果が報告されています。さらに、抗腫瘍作用を示す投与量で、正常細胞に対する毒性が低く、副作用がほとんど無いという特徴を持っています。
アルテスネイトは昔からマラリアの治療に使われていた生薬の成分で、その安全性や副作用が軽度であることが確かめられています。アルテスネイトなどのアルテミシニン誘導体は多彩な作用メカニズムで抗腫瘍効果を発揮することが報告されています。 がん細胞内でフリーラジカルを産生して酸化ストレスを高める作用、血管新生阻害作用、DNAトポイソメラーゼIIa阻害作用、細胞増殖や細胞死のシグナル伝達系に影響する作用などが報告されています。
臨床試験での有効性も報告されています。アルテスネイトは水溶性で、抗マラリア作用や抗がん作用はアルテミシン誘導体の中で最も高いと考えられています。毒性が極めて低いので、副作用がほとんど無いのが特徴です。しかし、体内での半減期が比較的短いという短所もあります。
アルテメーターは脂溶性で、アルテスネトより体内の半減期は長く、血液脳関門を容易に通過するので、脳マラリアや脳腫瘍にも効果があります。しかし、高用量を使用すると神経毒性が現れるという副作用があります。
アルテミシニンは、アルテスネイトとアルテメーターの2つの中間的な半減期をもち、血液脳関門も通過します。 米国では、これら3種類の成分を含有する製品がサプリメントとして販売されています。
【アルテスネイトはフェロトーシス(Ferroptosis)を誘導する】
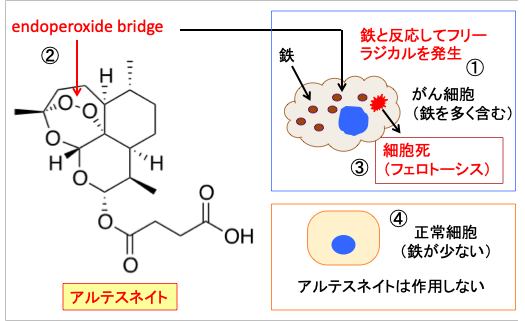
アルテスネイトやアルテミシンやアルテメーターはセスキテルペン・ラクトンの一種で、分子の中にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持っています。エンドペルオキシド・ブリッジ(-C-O-O-C-)は鉄イオンと反応してフリーラジカルを発生します。がん細胞は鉄を多く取り込んでいるので、その鉄と反応してフリーラジカルを産生してがん細胞を死滅させるという作用機序が提唱されています。つまり鉄介在性の細胞死です(図7)。
図7:がん細胞は細胞内に鉄を多く含む(①)。アルテスネイトは分子内にエンドペルオキシド・ブリッジ(endoperoxide bridge)を持つ(②)。このエンドペルオキシド・ブリッジは細胞内の鉄と反応してフリーラジカルを産生し、フェロトーシスの機序で細胞死を誘導する(③)。一方、正常細胞は鉄の含有が少ないので、アルテスネイトによる細胞傷害を受けない(④)。
このアルテスネイトによる鉄介在性の細胞死は2000年頃から知られており、がん治療の目的でアルテスネイトを服用する数時間前に鉄剤を服用してがん細胞に鉄を多く取込ませておくと、抗腫瘍効果を増強できることが指摘されています。
以前は、「がん細胞に多く含まれる2価の鉄イオンとアルテスネイトが反応してフリーラジカルを産生してがん細胞を死滅させる」と簡単に理解されていましたが、2012年にフェロトーシスという鉄介在性の細胞死の存在が提唱され、そのメカニズムが明らかになってきて、アルテスネイトの抗がん作用に注目が集まってきています。つまり、フェロトーシス促進によるがん治療においてアルテスネイトの利用が検討されています。
【細胞内のグルタチオンの濃度が減少すると酸化ストレスで死にやすくなる】
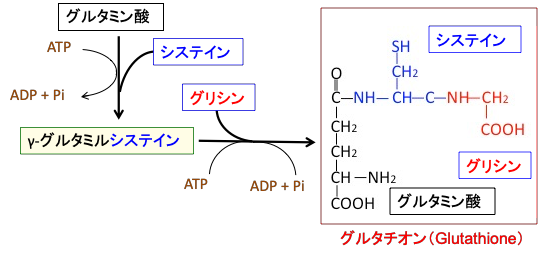
グルタチオン(Glutathione)は、グルタミン酸とシステインとグリシンの3つのアミノ酸が結合したトリペプチドです。
γ-グルタミルシステイン合成酵素によってグルタミン酸とシステインが結合してγ-グルタミルシステインを合成し、引き続いてグルタチオン合成酵素によってγ-グルタミルシステインにグリシンが結合してグルタチオンが合成されます。(図8)
図8:グルタチオンは3つのアミノ酸(グルタミン酸、システイン、グリシン)が結合して合成される。
グルタチオンは細胞内に0.5~10mMという非常に高濃度で存在します。
チオール基(SH基)を持ち、この水素が電子を供与することによって活性酸素やフリーラジカルを消去します。
還元型グルタチオンはGSH(Glutathione-SH)と表記され、GSHが活性酸素などで酸化されると酸化型グルタチオンGSSG(Glutathione-S-S-Glutathione)になります。
つまり、酸化型は、二分子の還元型グルタチオンがジスルフィド結合(2個のイオウ原子が繋がった状態)によってつながった分子です。
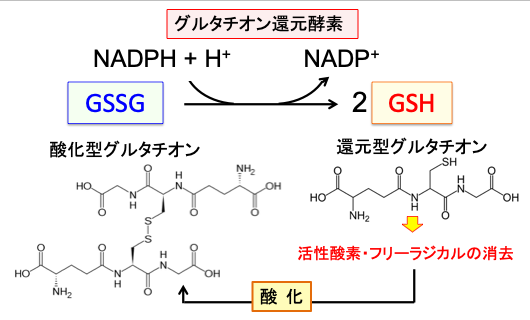
細胞内で発生した活性酸素やフリーラジカルに電子を与えて酸化型になったグルタチオンを還元型に戻す酵素がグルタチオンレダクターゼ(グルタチオン還元酵素)で、このときNADPH(ニコチンアミドアデニンジヌクレオチドリン酸、nicotinamide adenine dinucleotide phosphate)から水素をもらいます。NADPHはペントース・リン酸経路で産生されます。(図9)
図9:還元型グルタチオンは活性酸素(スーパーオキサイド、過酸化水素など)などと反応して酸化され、2量体化した酸化型グルタチオン(GSSG)に変化するが、グルタチオン還元酵素がNADPHからの電子をGSSGに転移して、GSH(還元型グルタチオン)に再生される。
【スルファサラジンはがん細胞のグルタチオン濃度を低下させて死にやすくする】
がん細胞が抗がん剤などで死ににくい理由の一つとして、グルタチオンの関与が指摘されています。 がん細胞は還元型グルタチオン(GSH)の合成を促進することで、酸化ストレス抵抗性を高め、増殖や転移や治療抵抗性を高めていることが知られています。
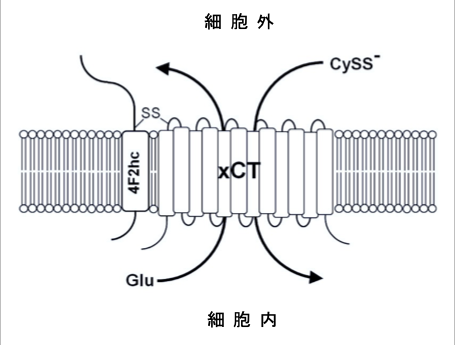
シスチン・トランスポーター(xCT)はシスチン/グルタミン酸交換輸送体とも呼ばれ、哺乳類細胞形質膜上に発現するアミノ酸トランスポーターの一種で、細胞内のグルタミン酸との交換により細胞外のシスチンを細胞内に輸送する機能を有します。
シスチンはグルタチオンの構成成分であるシステインが2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに代わってグルタチオンを合成する材料になるというわけです。
このトランスポーターの発現が亢進すると、細胞内グルタチオンレベルが上昇し、これによって、活性酸素などの酸化ストレスに対する防御能が高まると考えられます。(図10)
図10:システムxc-は、4F2重鎖(4F2hc)と軽鎖xCTで構成されており、これらはジスルフィド結合(-S-S-)で結合されている。 システムxc-は、グルタミン酸(Glu)と引き換えにシスチン(CySS-)を細胞内に取り込む。xCTは12回膜貫通型タンパク質。
スルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)という潰瘍性大腸炎の治療に使われている既存薬にシスチン・トランスポーターを特異的に阻害する作用があることが報告されています。
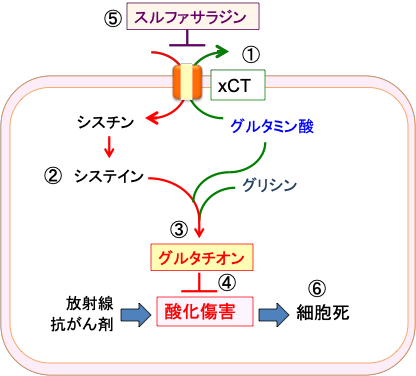
シスチントランスポーターの阻害剤であるスルファサラジンを投与すれば、がん細胞内のグルタチオンの濃度が低下し、酸化ストレスに対する抵抗性が低下するので、抗がん剤や放射線治療が効きやすくなると推測されます。(図11)
図11:シスチン/グルタミン酸交換輸送体(xCT) は、シスチンとグルタミン酸を輸送基質とする交換輸送体で、細胞内のグルタミン酸を放出し、細胞外のシスチンを取り込む(①)。シスチンはシステイン2分子がS-S結合したアミノ酸で、細胞内でシステインに還元される(②)。システインはグルタミン酸とグリシンと結合してグルタチオンが合成される(③)。グルタチオンは酸化ストレスを軽減することによって抗がん剤や放射線治療に抵抗性を与える(④)。xCTの働きを阻害する作用のあるスルファサラジンは、細胞内のシステインを減らしてグルタチオンの濃度を低下させ(⑤)
【メトホルミンはシスチンの取り込みを阻害する】
アンチポーターxCTは12回膜貫通型タンパク質です。遺伝子溶質キャリアファミリー7、メンバー11(SLC7A11)によってコードされます。以下の論文のSLC7A11はxCTのことです。
Metformin induces Ferroptosis by inhibiting UFMylation of SLC7A11 in breast cancer.(メトホルミンは、乳がんにおけるSLC7A11のUFMylationを阻害することによりフェロトーシスを誘発する)J Exp Clin Cancer Res. 2021 Jun 23;40(1):206.
【要旨】
背景: フェロトーシスは、脂質過酸化の鉄依存性の蓄積を特徴とする新たに定義された形態の細胞死であり、がんを含むさまざまな病態生理学的状態に関与している。がん治療の新規ターゲットとしてフェロトーシスが注目されている。FDA承認薬の中からフェロトーシス誘発作用のある薬の特定は、がん治療のための有望なアプローチであると提案されている。
抗糖尿病のメトホルミンはがん治療において有効性を示す証拠が増えているにもかかわらず、この有効性の根底にある正確なメカニズムはまだ完全には解明されていない。方法: SLC7A11のUFMylationは免疫沈降によって検出され、腫瘍組織におけるUFM1とSLC7A11の発現は免疫組織化学的染色によって検出された。フェロトーシスのレベルは、細胞内の遊離鉄、過酸化脂質およびグルタチオンのレベルによって決定され、ミトコンドリアの形態学的変化は透過型電子顕微鏡によって観察されタ。インビボでのメカニズムは、ヌードマウスにおける移植腫瘍モデルによって検証された。
結果: メトホルミンはAMPKに依存しない方法でフェロトーシスを誘発し、腫瘍の成長を抑制した。メトホルミンは細胞内のFe2+および過酸化脂質レベルを増加させた。具体的には、メトホルミンは、フェロトーシス調節因子であるSLC7A11のUFMylationプロセスを阻害することにより、SLC7A11のタンパク質安定性を低下させた。さらに、シスチン/グルタミン酸アンチポーターxCTの阻害剤のスルファサラジンをメトホルミンと併用すると、フェロトーシス誘発において相乗的に作用し、乳がん細胞の増殖を阻害した。
結論: この研究は、フェロトーシスを誘発するメトホルミンの能力が、その抗がん効果の根底にある新しいメカニズムである可能性があることを実証した最初の報告である。さらに、SLC7A11を新しいUFMylation基質として特定し、UFM1/SLC7A11経路を標的とすることが有望ながん治療戦略である可能性があることを発見した。
UFMylationはユビキチン様修飾因子UFM1 (Ubiquitin-fold modifier 1) が関連するタンパク質翻訳後修飾の一種です。メトホルミンはSLC7A11(xCT)タンパク質のUFMylationプロセスを阻害するメカニズムでxCTの働きを阻害するという報告です。
スルファサラジンとメトホルミンの併用はフェロトーシスの誘導を相乗的に促進することを示唆しています。
【ジスルフィラムは還元型グルタチオンを枯渇する】
ジスルフィラム(Disulfiram)はアルデヒド脱水素酵素を阻害する作用があり、断酒薬としてアルコール中毒の治療薬として60年以上前から処方薬として使用されています。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは副作用の少ない薬です。
アルデヒド脱水素酵素(ALDH)はアルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのです。
ALDH活性を阻害するとがん細胞の増殖や転移を抑制でき、抗がん剤の効き目を高めることができます。ジスルフィラムと銅の組合せ(複合体)はプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。
プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。
プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。
つまり、ジスルフィラムはプロテアソーム阻害作用による抗がん作用もあるということです。
ジスルフィラムはタンパク質のシステインに反応して活性を阻害する機序によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼなど様々ながん促進性のタンパク質を阻害します。
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
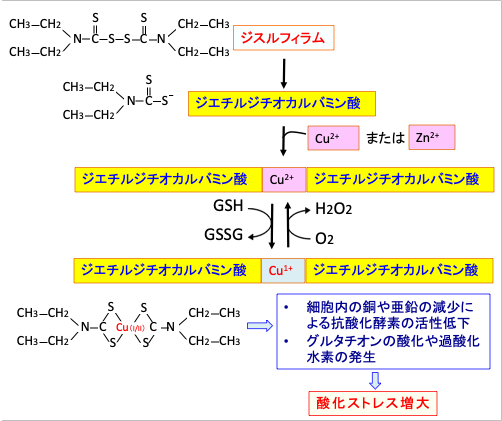
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。 (図12)
図12:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
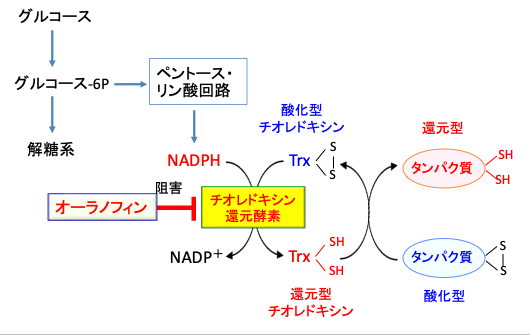
【オーラノフィンはチオレドキシン還元酵素を阻害する】
チオレドキシン(Thioredoxin: Trx)はグルタチオンとならんで細胞内を還元状態に保つ重要な物質で、様々なストレスから細胞を保護する機能を持ちます。分子内に酸化還元活性を有するSH基を持つ抗酸化酵素で、活性酸素から細胞を保護する作用を示すほか、細胞内シグナル伝達にも関与する多機能タンパク質です。
細胞内における主要な抗酸化機構の一つであり、細菌からヒトに至るまで普遍的に存在しています。チオレドキシン・システムは、チオレドキシン、チオレドキシン還元酵素、NADPHより構成されます。
還元型チオレドキシンは、酸化された標的タンパク質に結合し、標的タンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基は酸化されます。
酸化型チオレドキシンは、NADPHの存在下でチオレドキシン還元酵素の作用により還元され、 再び還元型に戻ります。NADPHはペントースリン酸回路で産生されます。オーラノフィンはチオレドキシン還元酵素を阻害します。(図13)
図13:チオレドキシンは活性部位の2つのシステイン基の間でジスルフィド(S-S)結合を作る酸化型とジチオール(-SH-SH)を作る還元型が存在する。還元型チオレドキシンは酸化された標的タンパク質に結合してタンパク質のジスルフィド結合(S-S)をチオール基(-SH)に還元し、チオレドキシン自身のチオール基(-SH)は酸化されてジスルフィド(S-S)になる。酸化型チオレドキシンはNADPHの存在下でチオレドキシン還元酵素の作用により還元され、再び還元型に戻る。NADPHはペントースリン酸回路で産生される。オーラノフィンはチオレドキシン還元酵素を阻害する。
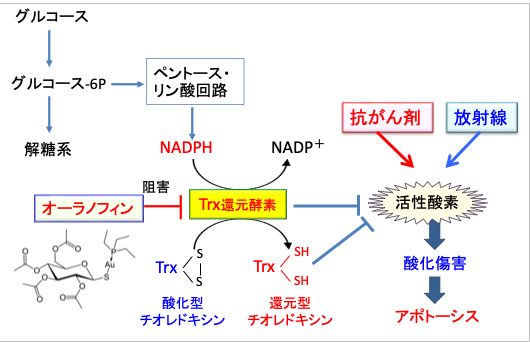
放射線や抗がん剤はがん細胞に活性酸素の産生を高めて酸化傷害を引き起こして死滅させます。これに対してがん細胞はチオレドキシン・システムを使って酸化傷害を軽減して細胞死に抵抗性を示します。
オーラノフィンはチオレドキシン(Trx)還元酵素を阻害してがん細胞の抗酸化力を低下させることによって、放射線治療や抗がん剤治療の効果を高めることができます。
一方、抗酸化剤は放射線や抗がん剤の抗腫瘍効果を阻害します。外来性にグルタチオンやN-アセチルシステインなどの抗酸化剤を摂取すると抗がん剤や放射線治療の効き目を弱めます。
オーラノフィンはがん細胞のチオレドキシン還元酵素を阻害する作用によって、酸化ストレスを高め、放射線治療や抗がん剤治療の効果を高めることが多くの実験で明らかになっています。以下のような報告があります。Auranofin radiosensitizes tumor cells through targeting thioredoxin reductase and resulting overproduction of reactive oxygen species(オーラノフィンは、チオレドキシンレダクターゼを阻害して活性酸素種の過剰産生を引き起こしてがん細胞の放射線感受性を増強する)Oncotarget. 2017 May 30; 8(22): 35728–35742.
【要旨】
オーラノフィンは関節リュウマチの治療薬であるが、がん細胞における酸化還元バランスを崩す作用があるため、抗がん剤治療との併用が検討されている。
この研究では、オーラノフィンが、還元性タンパク質のチオレドキシンを介して作用する抗酸化防御システムにおける重要な酵素であるチオレドキシン還元酵素を阻害することによって、がん細胞の放射線感受性を増強するかどうかを検討した。
マウスのがん細胞株の4T1およびEMT6を用いた実験で、3〜10μMのオーラノフィンがインビトロで強力な放射線増感剤であり、少なくとも2つのメカニズムによってチオレドキシン還元酵素による放射線感受性増強に関与することを明らかにした。
第1に、活性酸素を消去するN-アセチルシステインを添加するとオーラノフィンによる放射線感受性増強作用を妨げられるため、オーラノフィンの作用は酸化ストレスと関連している。
我々はまた、ミトコンドリアでの酸素消費を減少させることによって、低酸素条件下で放射線増感剤として作用する酸素を増やすことを認めた。
全体として、オーラノフィンによる放射線増感には、活性酸素の過剰産生、ミトコンドリア機能不全、DNA損傷およびアポトーシスが伴っており、これがオーラノフィンの細胞毒性と抗腫瘍効果のメカニズムになっていることが示された。
担癌マウスでは、オーラノフィンとブチオミン・スルホキシミン(buthionine sulfoximine)の併用によるチオレドキシンおよびグルタチオン系の同時阻害は、がん細胞の放射線感受性を有意に改善することが示された。
以上の結果から、放射線治療における抗腫瘍効果増強のターゲットとしてのチオレドキシン還元酵素の役割を明らかにし、放射線療法におけるオーラノフィンの併用が有用であることを示した。つまり、オーラノフィンは抗がん剤や放射線治療の抗腫瘍効果を高めることができます(図14)。
図14:放射線や多くの抗がん剤は活性酸素種を産生してがん細胞にダメージを与えて死滅させる。がん細胞はチオレドキシン活性を高めて、活性酸素種によるダメージに抵抗性を示す。オーラノフィンはチオレドキシン還元酵素の活性を阻害して、がん細胞の抗酸化力を減弱させる。したがって、オーラノフィンは放射線や抗がん剤の抗腫瘍効果を増強する。
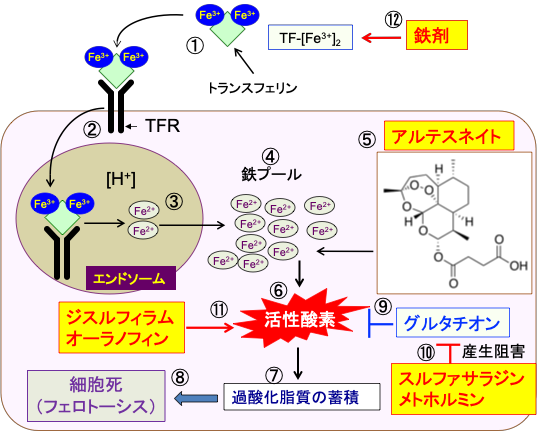
以上の研究結果から、アルテスネイト+スルファサラジン+メトホルミン+ジスルフィラム+オーラノフィン+鉄剤の組み合わせは、がん細胞のフェロトーシス誘導において相乗効果を発揮します。
実際にこの組み合わせをがん治療に応用していますが、副作用は少なく、がんを縮小する効果を確かめています。いずれも安価な薬です。 (図15)
図15:鉄はトランスフェリン(TF)に結合して全身を循環している。1分子のトランスフェリンは3価の鉄イオン(Fe3+)を2個運搬できる(①)。がん細胞はトランスフェリン受容体(TFR)を多く発現している。細胞膜に存在するトランスフェリン受容体に3価鉄イオンを結合したトランスフェリンが結合すると、この複合体はエンドサイトーシス (Endocytosis)によって細胞内に取り込まれる(②)。エンドソーム(endosome)内の酸性の環境では、鉄イオンはトランスフェリンから離れ、3価の鉄イオン(Fe3+)は2価の鉄イオン(Fe2+)に還元される(③)。2価の鉄イオンはエンドソームを出て細胞質に移行し、細胞内の様々な目的で使用される(④)。アルテスネイト(⑤)はがん細胞内の2価の鉄イオン(Fe2+)と反応して活性酸素を発生し(⑥)、酸化作用の強いヒドロキシルラジカルや脂質ラジカルを発生させ、過酸化脂質の蓄積を引き起こし(⑦)、フェロトーシスによる細胞死を誘導する(⑧)。がん細胞は活性酸素を消去するためにグルタチオンの産生を増やす(⑨)。スルファサラジンとメトホルミンはシスチン/グルタミン酸アンチポーター(xCT)の働きを阻害し、グルタチオンの合成を阻害する(⑩)。ジスルフィラムとオーラノフィンは活性酸素の産生を増やす(⑪)。鉄剤の投与はがん細胞内の鉄を増やしてフェロトーシスを促進する(⑫)。したがって、アルテスネイト+スルファサラジン+メトホルミン+ジスルフィラム+オーラノフィン+鉄剤はがん細胞のフェロトーシス誘導において相乗効果を発揮する。
【ドコサヘキサエン酸(DHA)はがん細胞のフェロトーシスを促進する】
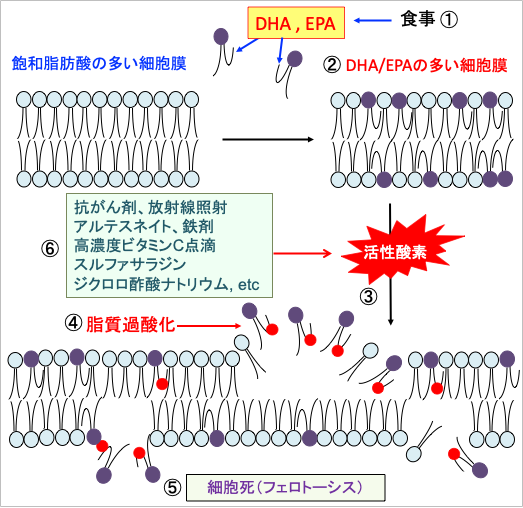
がん細胞は細胞分裂をして数を増やし、増殖します。細胞数を増やすために、細胞膜に使う脂肪酸の合成が亢進しています。さらに、がん細胞は自分で作った脂肪酸以外に、食事から摂取して血液中に存在する脂肪酸を積極的に取り込んで、細胞膜の合成に使います。食事からのドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)の摂取を増やすと、がん細胞の細胞膜にDHAやEPAが多く取り込まれます。
EPAは二重結合が5個、DHAは二重結合が6個存在する多価不飽和脂肪酸です。不飽和脂肪酸は酸化されて過酸化脂質になります。EPAやDHAは酸化されやすいので、鉄を多く含み、活性酸素の産生が増加しているがん細胞では、EPAとDHAは過酸化脂質を増やし、細胞膜の酸化傷害を増強します。つまり、EPAやDHAを多く取り込んだがん細胞はフェロトーシスが起こりやすくなるのです。
放射線治療や多くの抗がん剤は、がん細胞に活性酸素を産生してフェロトーシスで最終的に死滅することが明らかになっています。したがって、食事からのDHAとEPAの摂取を増やすと、放射線や抗がん剤による細胞死を起こしやすくなります。
放射線治療や抗がん剤治療以外で、がん細胞に活性酸素の発生量を増やす方法として、高濃度ビタミンC点滴、アルテスネイト、ジクロロ酢酸ナトリウムなどがあります。
さらに、瘍性大腸炎の治療に使われているスルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)はシスチン・トランスポーターを特異的に阻害し、がん細胞内のグルタチオンの濃度を低下し、抗がん剤や放射線治療が効きやすくします。
がん細胞にDHAを多く取り込ませた後に、このような活性酸素を多く発生する治療を行うと、がん細胞を選択的に死滅できます。(図16)
図16:食事(①)からのドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)は細胞膜に取り込まれる(②)。多価不飽和脂肪酸は酸化を受けやすいので、がん細胞内で鉄介在性に活性酸素の産生が高まると(③)、脂質の過酸化によって細胞は酸化傷害を受け(④)、フェロトーシスの機序で死滅する(⑤)。抗がん剤、放射線照射、アルテスネイト、鉄剤、高濃度ビタミンC点滴、スルファサラジン、ジクロロ酢酸ナトリウムはがん細胞に比較的選択的にフェロトーシスを誘導する(⑥)。食事からのDHA/EPAの摂取量を増やすと、がん細胞のフェロトーシスを増強できる。(赤丸は活性酸素による脂質酸化を示す。多価不飽和脂肪酸は酸化を受けやすいことを示している。)
【ジクロロ酢酸ナトリウムはミトコンドリアを活性化して活性酸素の産生を増やす】
ジクロロ酢酸ナトリウム(sodium dichloroacetate)は酢酸(CH3COOH)のメチル基(CH3)2つの水素原子が塩素原子(Cl)に置き換わったジクロロ酢酸(CHCl2COOH)のナトリウム塩です。構造式はCHCl2COONaになります。
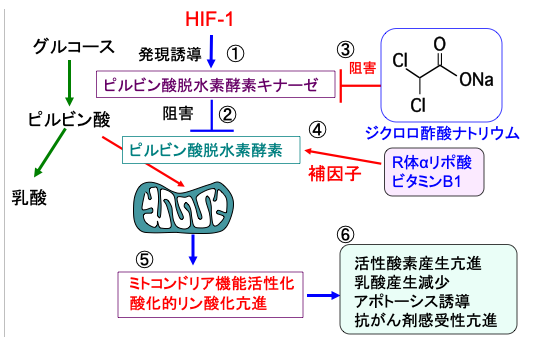
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害することによってピルビン酸脱水素酵素の活性を高める作用があります。ミトコンドリアの異常による代謝性疾患、乳酸アシドーシス、心臓や脳の虚血性疾患の治療などに、医薬品として古くから使用されています。
がん治療の場合は、体重1kg当たり10~15mgを水に溶かして服用します。
ピルビン酸脱水素酵素の補因子のビタミンB1とR体αリポ酸を併用すると抗腫瘍効果を高めることができます。 (図17)
図17:低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの発現を誘導して(①)、ピルビン酸脱水素酵素(ピルビン酸をアセチルCoAに変換する)の働きを阻害するので(②)、ミトコンドリアでの酸化的リン酸化によるATP産生が抑制されている。ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼの活性を阻害することによってピルビン酸脱水素酵素の活性を高め(③)、R体αリポ酸とビタミンB1はピルビン酸脱水素酵素の補因子として働き(④)、ピルビン酸脱水素酵素の活性を高めてピルビン酸からアセチルCoAの変換を促進し、TCA回路での代謝と酸化的リン酸化を亢進する(⑤)。ミトコンドリアでの酸化的リン酸化が亢進すると、活性酸素の産生が増え、乳酸産生が減少し、アポトーシスが起こりやすくなって、抗がん剤感受性が亢進する(⑥)。
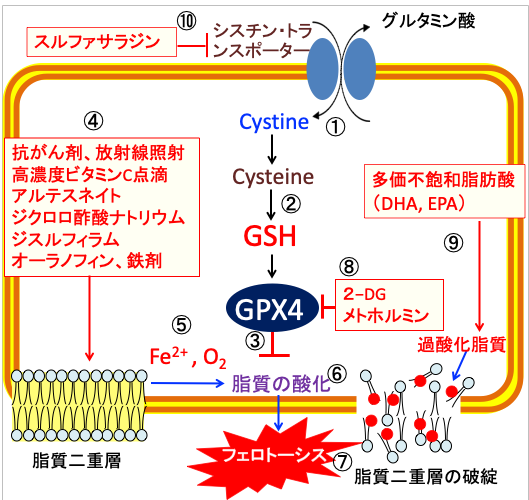
さらに、2-デオキシ-D-グルコースを併用すると、解糖系とペントースリン酸経路を阻害してNADPHの産生を減少し、がん細胞の抗酸化力を低下できます。
これらを併用すると、がん細胞に選択的にフェロトーシスを誘導できます。(図18)
図:シスチン・トランスポーターはシスチン/グルタミン酸交換輸送体とも呼ばれ、細胞内のグルタミン酸との交換により細胞外のシスチン(Cystine)を細胞内に輸送する(①)。シスチンはグルタチオンの構成成分であるシステイン(Cysteine)が2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに変換されて還元型グルタチオン(GSH)の合成が増える(②)。グルタチンペルオキシダーゼ4(GPX4)は細胞膜の脂質の酸化を防ぐ(③)。抗がん剤、放射線照射、高濃度ビタミンC点滴、アルテスネイト、ジクロロ酢酸ナトリウム、ジスルフィラム、オーラノフィン、鉄剤は活性酸素の産生を増やし(④)、二価の鉄イオン(Fe2+)と酸素(O2)が介在した機序で(⑤)、脂質酸化を促進し(⑥)、脂質二重層の破綻によってフェロトーシスによって死滅する(⑦)。2-デオキシ-D-グルコース(2-DG)とメトホルミンはATPとNADPHの産生を減らしてグルタチンペルオキシダーゼ4(GPX4)の活性を低下する(⑧)。ドコサヘキサエン酸(DHA)とエイコサペンタエン酸(EPA)は多価不飽和脂肪酸で酸化されやすいので、細胞膜の脂質過酸化を促進する(⑨)。スルファサラジンはシスチン・トランスポーターの働きを阻害してグルタチオンの合成を阻害する(⑩)。これらを組み合わせると、がん細胞に選択的にフェロトーシスによる細胞死を誘導できる。
費用の目安: 服用量は病状や治療の状況により異なります。
服用量(1日分) 費用(30日分) アルテスネイト スルファサラジン メトホルミン ジスルフィラム オーラノフィン 鉄剤 1,500円 微細藻類由来DHA ジクロロ酢酸ナトリウム 5mg〜10mg/体重1kg 12,000円 ビタミンB1 150mg 3,600円 R体α-リポ酸 66mg 5,000円 2-デオキシ-D-グルコース これらを全て飲み薬ですので、自宅で服用できます。これらを併用すれば、がん細胞をフェロトーシスの機序で死滅できます。
全てを併用すると1ヶ月分は10万円程度になりますが、副作用が少なく、がん細胞を死滅できるので、試してみる価値はあります。治療法に関するご質問やお問合せは、電話(03-5550-3552)かメール(info@f-gtc.or.jp)でお願いします。