ラパマイシンに関する薬剤情報
注:このサイトの記事は「ラパマイシンの薬剤情報」に関して医学論文に報告されている内容をまとめたものです。特定のがん治療を宣伝・広告するものではあリません。
【寿命延長効果と抗がん作用を持つラパマイシン】
ラパマイシン(Rapamycin)という薬があります。シロリムス(Sirolimus)という別名で呼ばれることもあります。これは臓器移植の際の拒絶反応を防ぐために使用される薬ですが、このラパマイシンに寿命延長効果と抗がん作用が明らかになったことから、ラパマイシンの生体内のターゲット分子である哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)という蛋白質が注目されています。
ラパマイシンは1970年代にイースター島(モアイ像で有名な南太平洋の島)の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生する有機化合物です。イースター島はポリネシア語で「ラパ・ヌイ(Rapa Nui)」と言い、この「ラパ」と「菌類が合成する抗生物質」を意味する接尾語の「マイシン」とを組み合わせて「ラパマイシン」と名付けられています。
ラパマイシンの薬効としては、臓器移植の拒絶反応を防ぐ作用の他に、抗がん作用や寿命延長効果が知られています。寿命延長作用については、生後600日のマウス(人間では60歳ほどに相当)にラパマイシンを投与すると、通常に比べてメスは平均で13%、オスは9%長生きしたという動物実験の結果が報告されています。
寿命を延ばす方法として現時点で最も確実なのがカロリー制限です。カロリー制限とは、栄養障害(ビタミンやミネラルやタンパク質の不足)を起こさずに食事からの摂取カロリーを30~40%程度減らす食事を行うことで、カロリー制限には老化を遅延して寿命を延ばし、がんを含めて老化関連疾患の発症を抑制する効果が認められています。
このカロリー制限による老化過程の遅延と寿命延長とがん抑制に最も重要な因子がmTORです。 ラパマイシン自体に抗がん作用が報告されていますが、ラパマイシンの構造を改変した物質(ラパマイシン誘導体)が抗がん剤として開発されて、すでに幾つかの薬が臨床で使用されています。
このようなラパマイシンの多彩な薬効は、細胞の増殖やエネルギー産生に重要な役割を担っている細胞内蛋白質に作用することによって発揮されますが、このラパマイシンがターゲットにする蛋白質がmTORという蛋白質なのです。。
【ラパマイシンはmTORC1を阻害する】
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼ(タンパク質のセリンやスレオニンをリン酸化する酵素)で、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。 初め、酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログ(相同体)が見出されてmTOR(哺乳類ラパマイシン標的タンパク質)と命名されました。
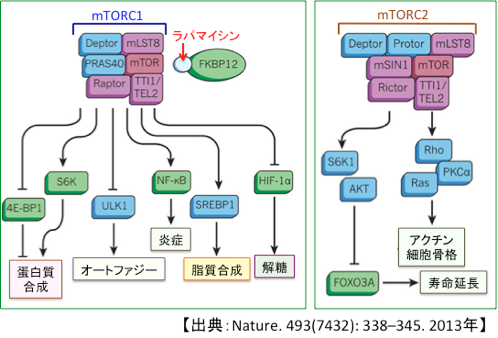
mTORにはmTOR複合体1((mammalian target of rapamycin complex 1:mTORC1)とmTOR複合体2(mammalian target of rapamycin complex 2:mTOR2)の2種類があります。mTORに幾つかの他のタンパク質が結合して複合体を形成しますが、結合しているタンパク質の違いで2種類の複合体ができ、異なる機能を担っています。(下図)
mTOR(哺乳類ラパマイシン標的タンパク質)は2種類の複合体(mTORC1とmTORC2)として存在する。mTORC1とmTORC2はそれぞれ異なる蛋白質と複合体を形成し、それぞれ異なる機能をもつ。ここに記載されているエフェクタータンパク質は一部であり、もっと多くのタンパク質が関与している。まだ十分に解明されていない部分も多い。 例えば、mTORC1はタンパク質翻訳を抑制する4E-BPをリン酸化してその機能を抑制する。また、リボソームの生合成を促進するS6Kをリン酸化して活性化する。これらの作用によってmTORC1は蛋白質合成を促進する。その他、多くの標的タンパク質をリン酸化することによって細胞内のタンパク質合成を促進することによって細胞の増殖や物質代謝を制御する。また、細胞内小器官の消化・再利用に重要なオートファジーを抑制する作用や、低酸素誘導因子-1(HIF-1)を活性化して解糖系を亢進する作用、脂質合成を亢進する作用などもある。 このように、mTORC1は栄養素の供給状況や増殖刺激や細胞内のエネルギーの状況などに対するセンサーとして作用し、細胞内の物質代謝やエネルギー産生を調節する中心的な役割を担っている。一方、mTORC2は細胞骨格やシグナル伝達の制御などに関与している。mTORC2はS6K1とAKTの活性化を介して、細胞の寿命を延長するFOXO3aを抑制する作用がある。ラパマイシンはFKBP12と結合し、mTORとraptorの相互作用を阻害することによってmTORC1の活性を阻害する
mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。インスリンやインスリン様成長因子やロイシンによって活性化されるのはmTORC1の方です。ラパマイシンで阻害されるのもmTORC1の方です。
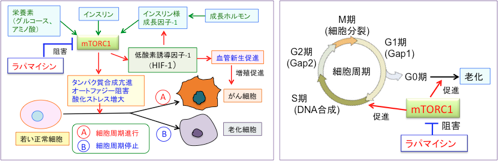
mTORC1は、糖やアミノ酸などの栄養素の状況、エネルギー状態、成長因子(増殖因子)などによる情報を統合し、エネルギー産生や細胞分裂や生存などを調節しています。 細胞の増殖というのは、栄養とエネルギーが利用できる状態にあるときに、新たな細胞構成成分(タンパク質、核酸、脂質など)を合成して、細胞の数を増やす生化学的プロセスのことです。したがって、増殖するためには、細胞を新たに作る材料(栄養素)とエネルギー(糖質や脂質を分解して得られるATP)が必要です。増殖因子や成長因子やホルモンなどによって細胞増殖の指令(シグナル)が来たときに、栄養素とエネルギーの供給が十分にあることを判断し、タンパク質や脂質の合成を促進して細胞増殖を実行するスイッチを入れるのがmTORC1です。
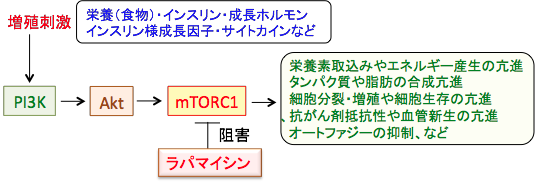
栄養摂取やインスリン、成長ホルモン、IGF-1、サイトカインなどの増殖刺激が細胞に作用すると、それらの受容体などを介してPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。このAktのターゲットの一つがmTORC1というわけです。 Aktによってリン酸化(活性化)されたmTORC1は細胞分裂や細胞死や血管新生やエネルギー産生などに作用してがん細胞の増殖を促進します(下図)。
栄養摂取やインスリン、インスリン様成長因子-1(IGF-1)、サイトカインなどの増殖刺激が細胞に作用すると、PI3Kが活性化され、その下流に位置するAktの活性化、mTORC1の活性化と増殖シグナルが伝達される。mTORC1は栄養素の取込みやエネルギー産生、細胞分裂・増殖、細胞生存、抗がん剤抵抗性、血管新生を亢進し、オートファジー(自食作用)を抑制するので、mTORC1の活性化はがん細胞の発生や増殖や転移を促進する方向で働く。ラパマイシンはmTORC1の活性を直接阻害することによって抗がん作用を発揮する
この経路をPI3K/Akt/mTORC1経路と言い、がん細胞や肉腫細胞の増殖を促進するメカニズムとして極めて重要であることが知られています。すなわち、PI3K/Akt/mTORC1経路の阻害はがん細胞や肉腫細胞の増殖を抑制し、細胞死(アポトーシス)を誘導することができるため、がん治療のターゲットとして注目されています。
PI3K/Akt/mTORC1経路の阻害は、抗がん剤や放射線治療の効き目を高める効果や、血管新生を阻害することによってがん細胞の増殖を抑制する効果も報告されています。
低酸素誘導因子-1(HIF-1)はmTORC1によって活性化されるため、ラパマイシンはHIF-1の活性を阻害することによってがん細胞の代謝異常(解糖系亢進)を正常化する作用があります。 mTOR阻害剤は免疫抑制という欠点を持ちますが、がん細胞や肉腫細胞の多くにおいてmTORが活性化されているため、抗がん剤として有効性が高く、すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。(免疫に関しては単純な免疫抑制ではなく、記憶キラーT細胞の数を増やすなど抗腫瘍免疫にはプラスに働く面も報告されています。)
【がん細胞では細胞内シグナル伝達系に異常が多発している】
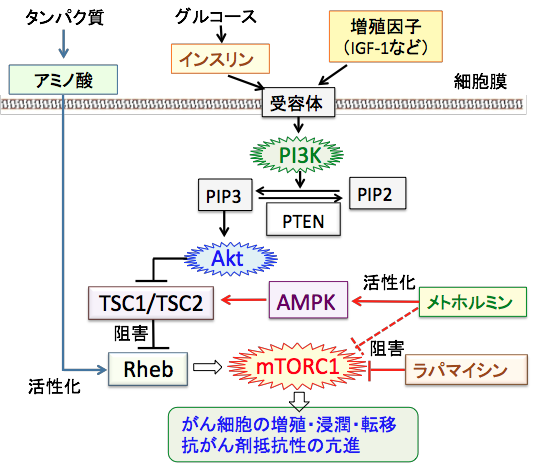
mTORC1の活性の制御には、多数の抑制因子(AMPKやTSC1/TSC2など)や促進因子(インスリン、インスリン様成長因子-1、Akt、アミノ酸など)が関わっています。 これらの制御系や細胞内のシグナル伝達系が正常に働いていれば、メトホルミンでAMPKを活性化すればmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)は抑制できます。 糖質摂取の制限やケトン食によってインスリン/インスリン様成長因子-1のシグナル伝達系を抑制してもmTORC1の抑制に効果があります。
しかし、がん細胞の場合は、このようなシグナル伝達系の上流で作用する薬を使っても必ずしもうまくいきません。それは、このシグナル伝達系の至るところで異常が起きているからです。 メトホルミンでAMPKを活性化しても、AMPKとmTORC1との間に存在するタンパク質(TSC1/TSC2やRheb)が異常を起こしていればmTORC1は抑制できません。インスリンの分泌を減らしても、PI3KやAktが遺伝子異常で恒常的に活性化しておればmTORC1の抑制はできません。
実際に、がん細胞ではAkt遺伝子の増幅(数が増えていること)や、PI3KやAktやmTORC1の活性を抑制するがん抑制遺伝子(PTENやTSC1/TSC2など)の遺伝子変異など、PI3K/Akt/mTORC1/HIF-1シグナル伝達系の至るところで異常が起こっていることが明らかになっています。
グルコースの取込みや解糖系の阻害は、エネルギー産生と物質合成を直接的に阻害するので、PI3K/Akt/mTOR/HIF-1シグナル伝達系の異常があっても効果は期待できますが、抗腫瘍効果は減弱します。 そこで遺伝子異常が高度に生じている進行がんの治療の場合は、mTORC1を直接阻害する薬が必要になります。メトホルミンやケトン食や解糖系の阻害(2-デオキシグルコースなど)でがん細胞の増殖が十分に抑制できない場合は、mTORC1に直接的に作用する薬(ラパマイシンやその誘導体)の併用が有効と言えます(図)。(メトホルミンはAMPKの活性化を介する機序以外に、mTORC1を直接阻害するという報告もある)
栄養摂取やインスリンやインスリン様成長因子-1(IGF-1)などの増殖刺激が細胞に作用するとPI3Kが活性化され、これがAktをリン酸化して活性化する。活性化したAktは細胞内のシグナル伝達に関与する様々な蛋白質の活性を制御することによって細胞の増殖や生存(死)の調節を行う。がん細胞では、PI3K/Akt/mTORC1シグナル伝達系に関与する様々なタンパク質の遺伝子変異などによってAktやmTORC1が恒常的に活性化しており、さらに、AMPKとmTORC1の間のシグナル伝達に関与するTSC1/TSC2やRhebに変異があるとメトホルミンでAMPKを活性化してもmTORC1を抑制できない。ラパマイシンやラパマイシン誘導体はmTORC1を直接阻害する。(メトホルミンはAMPKを介してmTORC1活性を抑制するルート以外に、mTORC1を直接阻害する作用があるという報告もある)
【mTOR阻害剤は老化性疾患の発生を遅らせ寿命を延長する】
マウスを使った実験では、mTORの活性を遺伝子改変や阻害剤(ラパマイシンなど)で抑制すると、老化関連疾患の発生が遅くなり、寿命が延びることが報告されています。例えば、遺伝子改変技術によってmTORタンパク質を生存に最低限必要な約25%しか生成できないマウスを作成したところ、寿命が正常マウスに比べて約20%延びることが報告されています。(Cell Rep. 4(5): 913–920. 2013)
また、mTOR阻害剤のラパマイシンがアルツハイマー病などの神経変性疾患を改善することが報告されています。知能機能低下をきたす遺伝性疾患では、mTOR活性が亢進しており、mTOR活性を低下させると知能が良くなることが多くの研究で明らかになっています。
がんも老化性疾患の代表と言えます。mTORの阻害剤ががんの発生を予防することは多くの研究で明らかになっています。 mTOR阻害は免疫細胞の働きを弱めるので、免疫力低下から感染症にかかりやすくなるデメリットがあるのですが、がん(悪性腫瘍)やアルツハイマー病や認知機能低下や心臓疾患や腎臓疾患などの老化性疾患に対して老化を抑制する方向で作用することが明らかになっています。 免疫系に対する作用の関しては、臓器移植の拒絶反応に使用されるように、一般的にはTリンパ球の働きを抑制するのですが、記憶CD8+T細胞を増やして抗腫瘍免疫にプラスに働く作用もあります。 mTORC1は膵臓のランゲルハンス島のβ細胞の量を増やし、インスリン分泌を促進する作用があるので、mTORC1の阻害はインスリンの分泌を減少させて2型糖尿病の発症を促進する可能性が指摘されています。しかし、糖尿病の合併症の微小血管病変(糖尿病性の網膜症や腎症や神経症)や大動脈の動脈硬化に対しては、mTORC1は低酸素誘導因子-1を活性化し血管内皮増殖因子(VEGF)を増やして血管新生を促進するので、これらの血管病変を悪化させます。したがって、糖尿病の合併症の抑制にラパマイシンが有効という報告はあります。
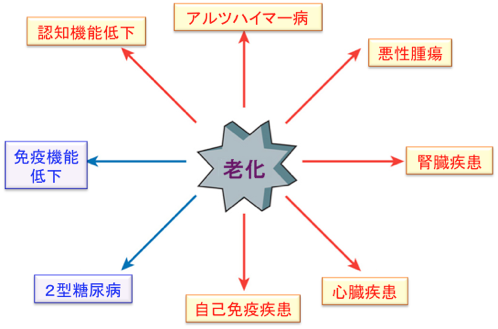
老化が関連する様々な疾患のうち、認知機能低下、アルツハイマー病、悪性腫瘍、腎臓疾患、心臓疾患、自己免疫疾患など多くの疾患に対してラパマイシンなどのmTORC1阻害剤は改善する方向で作用しますが、免疫機能低下と2型糖尿病に関しては、改善と悪化の両方の作用を示すようです。 免疫機能においてエフェクターT細胞の増殖を抑えますが、記憶キラーT細胞の数を増やす作用があります。糖尿病においては、微小血管障害などの合併症を抑制する効果が指摘されています(下図)。
老化性疾患に対するmTORC1の影響。
老化は様々な疾患の発症と進展の原因になるが、それらはmTORC1シグナル伝達系の影響を受けている。赤の矢印で示した疾患はラパマイシンで改善される。一方、青の矢印で示した疾患に関してはラパマイシンは促進と抑制の両方の作用を示す。
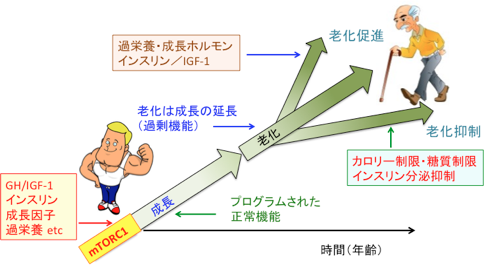
(出典:Nature. 493(7432): 338-345, 2013年)生まれてから生殖年齢に達するまで生き物は成長します。この成長過程において、成長ホルモンやインスリン、インスリン様成長因子、PI3K/AKT/mTORシグナル伝達系、性ホルモン、その他様々な成長因子などが重要な役割を果たしますが、特にmTORが細胞の増殖や成長の中心的役割を果たしています。 成長が終了したあとは、成長に関わってきた多くの因子が老化を促進し、がんの発生を促進する方向で作用します。つまり、老化は成長の延長であり、過剰機能と言えます(図)。
mTOR(哺乳類ラパマイシン標的タンパク質)は成長ホルモン(GH)やインスリン様成長因子-1(IGF-1)やインスリンや様々な成長因子や過剰な栄養によって活性化され、細胞の増殖や体の成長に中心的な役割を担っている。成長が終了したあともmTORC1の働きが過剰に続くと、細胞や組織の老化が促進される。成長終了後はmTORC1の活性は老化と発がんを促進する方向に作用する。
mTORC1は成長を促進しますが老化も促進します。したがって、成長が終了した段階でmTORC1を低下させるようにスイッチを切り替えるとその個体の寿命を延ばすことができます。 「老化は成長の延長」という生物の根本的な仕組みを利用すれば、自然の摂理に逆らって寿命を延ばすことができます。つまり、mTORC1自体あるいはmTORC1の活性化に関わる要因を減らせば、老化性疾患の予防と寿命の延長を達成できます。
成長が終了し生殖年齢に達したあとはmTORの活性を高めるようなことはがんの発生を促進し、寿命を短くすることになります。 つまり、体重や筋肉を増やすようなスポーツは老化や発がんを促進する可能性が高いといえるかもしれません。 牛乳タンパク質や糖質の多い食事も、mTORC1の活性を高めて老化を発がんを促進する可能性があります。 アンチエイジング(抗加齢)の治療では、年齢とともに低下した成長ホルモンや性ホルモンやインスリン様成長因子-1(IGF-1)を補って若返りをはかる方法が行われていますが、確かに短期的には体は若返りますが、長期的な寿命とがん発生リスクの上昇ということを犠牲にしている可能性があります。
mTORC1(哺乳類ラパマイシン標的タンパク質複合体1)は細胞のがん化と老化の両方に関与している。栄養素(グルコースやアミノ酸など)、インスリン、インスリン様成長因子、その他の増殖因子はmTORC1シグナル伝達系を活性化し、細胞の成長や細胞周期(細胞分裂した細胞が再び分裂を起こすまでの過程)の進行を促進する。遺伝子変異などによって細胞周期の制御に異常が起こり、止めどなく細胞分裂を行うようになった細胞ががん細胞であり、細胞周期が進行しているがん細胞に対してはmTORC1の活性化は細胞増殖を促進することになる。一方、細胞が古くなってきて細胞周期が停止している細胞(G0期)にmTORC1活性が亢進すると細胞は老化した状態(完全に細胞増殖能を喪失し細胞機能も低下する)に移行する。ラパマイシンはmTORC1の活性を阻害することによって、細胞のがん化と老化の両方を抑制することができる。
【ラパマイシンの抗がん作用について】
mTORC1阻害剤でがん治療に使われているものとしてEvelorimus(商品名:アフィニトール)などがありますが、これはラパマイシン誘導体(Rapalogs)です。 ラパマイシンは元々は臓器移植の拒絶反応を予防する免疫抑制剤です。通常、免疫抑制剤はがんの発生率を高めるのですが、ラパマイシンは逆にがんの発生率を顕著に減少させる作用があることが明らかになりました。つまり、腎臓移植や肝臓移植を受けた患者さんを追跡調査するとラパマイシンを服用している患者さんはがんの発生率が極めて低いことが多くの研究で明らかになっています。
ラパマイシンの抗がん作用の研究は数多くあります。例えば、頭頚部扁平上皮がんや皮膚扁平上皮がんの治療や治療後の再発予防にラパマイシンが有効であることを示す報告が多数あります。
頭頚部の扁平上皮がんは6番目に多いがんで、世界中で1年間に50万人以上が発症し、米国だけで年間11000人がこの病気で死亡しているそうです。日本でも、肺がん、胃がん、大腸がん、肝臓がん、膵臓がん、乳がんなどに続いて6から7位くらいのようです。 日本の頭頸部癌の罹患率および死亡率は近年増加しています。頭頸部がんに関しては日本では年間約2万人が発症し、年間約9500人が死亡していると言われています。5年生存率は50%前後でこの30年間ほとんど改善はないということです。
このように治療成績が悪い理由の一つは、頭頚部は体の中でも特にリンパ管やリンパ節が多く存在し、リンパ節転移が起こりやすいためです。そして、診断時にリンパ節転移があると、再発しやすく予後は非常に悪くなります。 診断時に明らかなリンパ節転移の所見がなくても、10~50%の頻度で潜在的なリンパ節転移が存在すると考えられています。 そこで、頭頚部扁平上皮がんの生存率を良くするためには、リンパ節転移を抑制することが重要になります。 頭頚部扁平上皮がんの80%以上で、Akt/mTORシグナル伝達系の活性が亢進していると報告されています。
mTORは上皮細胞成長因子受容体の発現量と活性を高めます。mTORC1はリンパ脈管新生を促進し、リンパ節転移を増やす作用があります。したがって、ラパマイシンは扁平上皮がんの増殖や転移を抑制する効果が期待できます。
がん細胞ではがん抑制遺伝子のp53の変異が高頻度で起こっており、p53の変異があるがん細胞は治療に抵抗性を示します。ラパマイシンはp53の変異をもつがん細胞にも有効であることが報告されています。
多くの研究結果から、頭頚部の扁平上皮がんや皮膚がんの治療や、再発リスクの高い場合の再発予防にmTORC1阻害剤のラパマイシンを積極的に使用するメリットはありそうです。その他の多くの種類のがんについても、ラパマイシンが抗腫瘍効果を示すことが報告されています。
【他のがん治療との併用における安全性】
その作用機序から、ラパマイシンは抗がん剤治療や放射線治療の効き目を高める可能性が高いと言えます。その理由は、mTORC1を阻害すると、がん細胞は物質の同化が阻害されるので、ダメージを回復できないからです。 そこで、問題は、抗がん剤や放射線治療と併用した場合の安全性です。前述のように副作用が軽減する可能性が指摘されていますが、今まで行われている臨床試験の結果を調べておくことが必要です。
Phase I study of vinblastine and sirolimus in pediatric patients with recurrent or refractory solid tumors.(再発あるいは治療抵抗性の固形がんの小児患者におけるビンブラスチンとシロリムスの併用療法の第1相試験)Pediatr Blood Cancer. 61(1): 128-33, 2014年
シロリムス(Sirolimus)というのはラパマイシンの別名で同じ物質です。この臨床試験では再発性あるいは治療抵抗性の固形がん(脳腫瘍を含む)の患者14人(平均年齢8.7歳: 2.3歳から19歳)を対象にして、シロリムス(ラパマイシン)は血中濃度が10~15ng/mlになるように調整しながら経口投与で行い、ビンブラスチンとの併用を実施しています。 毒性はビンブラスチンの最高用量でグレード3の口腔粘膜炎が1例に認められました。骨髄抑制が最も頻度の高い副作用でした。1mgのラパマイシンの服用当たり血中濃度は約2ng/ml上昇しています。28日目には血中の可溶性血管内皮増殖因子受容体(sVEGFR2)が顕著に低下し、血管新生の阻害作用が認められています。
治療効果が検討できた11例のうち部分奏功が1例、3ヶ月以上の病状安定が3例に認められました。 この論文の結論は「mTOR阻害剤とビンクリスチンの併用療法は長期間の投与でも安全であり、血中を循環している血管新生を促進する因子(VEGFR2)を減らし、奏功率を高めた。」と言っています。A phase I study of decitabine and rapamycin in relapsed/refractory AML.(再発/治療抵抗性の急性骨髄性白血病に対するデシタビンとラパマイシンの併用療法の第1相試験)Leuk Res. 37(12): 1622-7, 2013年
この臨床試験では再発して治療抵抗性になった成人の急性骨髄性白血病患者12名を対象、メチル化阻害剤のデシタビンという抗がん剤を5日間投与(20mg/体表面積1平方メートル)し、その後20日間(day 6 to day 25)ラパマイシンを1日2mg,4mg, 6mgで投与しています。4例にグレード3の口腔粘膜炎を認めた以外には目立った副作用は認めなかったという結果が報告されています。
Clinical activity of mTOR inhibition in combination with cyclophosphamide in the treatment of recurrent unresectable chondrosarcomas.(再発した切除不能の軟骨肉腫の治療におけるmTOR阻害剤とシクロフォスファミドの併用療法の臨床的有効性)Cancer Chemother Pharmacol. 70(6):855-60. 2012年
軟骨肉腫は稀な腫瘍で、外科切除で腫瘍を取り除くことが最も基本的な治療です。再発したり大きくなって切除ができない場合は、抗がん剤や放射線治療が行われますが、軟骨肉腫は抗がん剤や放射線に感受性が低いので、外科切除の対象にならない場合は、極めて予後不良となります。 この論文では、このような再発性の切除不能の進行した軟骨肉腫の患者10例を対象にして、ラパマイシン(シロリムス)とシクロフォスファミドを併用した抗がん剤治療の効果を検討しています。その結果、1例では腫瘍の縮小がみられ、6例では6ヶ月以上の進行停止がみられ、3例が病状進行という結果でした。無増悪生存期間の中央値は13.4ヶ月(3から30.3ヶ月)でした。大きな副作用は認めなかったということです。 除不能の軟骨肉腫の抗がん剤治療としてラパマイシンとシクロフォスファミドは有望な組合せであると、この論文の結論で述べています。