AMP活性化プロテインキナーゼ、mTORC1、FOXO3Aをターゲットにしたがん治療
【AMP活性化プロテインキナーゼを活性化するとがん細胞の増殖が抑えられる】
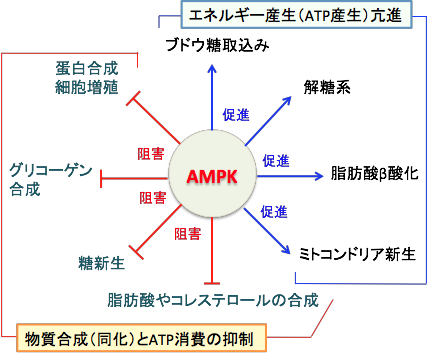
AMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)は人から酵母まで真核細胞に高度に保存されているセリン/スレオニンキナーゼ(セリン/スレオニンリン酸化酵素)の一種で、細胞内のエネルギーのセンサーとして重要な役割を担っています。 全ての真核生物は、細胞が活動するエネルギーとしてアデノシン三リン酸(Adenosine Triphosphate :ATP)というヌクレオチドを利用しています。 ATPは「生体のエネルギー通貨」と言われ、エネルギーを要する生物体の反応過程には必ず使用されています。 ATPがエネルギーとして使用されるとADP(Adenosine Diphosphate:アデノシン-2-リン酸)とAMP(Adenosine Monophosphate:アデノシン-1-リン酸)が増えます。 すなわち、ATP → ADP + リン酸 → AMP+2リン酸というふうに分解され、リン酸を放出する過程でエネルギーが産生されます。 AMPKはこのAMPで活性化されるタンパクリン酸化酵素で、カロリー制限、運動、低グルコース、低酸素、虚血のような細胞内 ATP 供給が枯渇する状況において、AMPの増加に反応して活性化されます。 すなわち、AMPKはATPの減少を感知して活性化し、ATPのレベルを回復させるように代謝を調整します。(下図)
図:AMP活性化プロテインキナーゼ(AMPK)の代謝調節作用。 AMPKは細胞内エネルギー(ATP)減少を感知して活性化し、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる効果がある。AMPKが活性化すると、糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生される。
がん細胞でもAMPKの活性が抑制されており、AMPKを活性化するとがん細胞の増殖を抑制できることが報告され、AMPKはがんの予防や治療のターゲットとして有望視されています。 AMPKの活性化ががん細胞の増殖を抑制する効果があることは、培養がん細胞や移植腫瘍を使った動物実験など多くの基礎研究で明らかになっています。AMPKは細胞増殖の制御に関連する幾つかのたんぱく質の活性に影響します。次のようなメカニズムが報告されています。
1)AMPKはがん抑制遺伝子のp53を活性化して、がん細胞の増殖を抑制します。一方、p53の活性化はAMPKを活性化します。つまり、AMPKとがん抑制遺伝子p53は相互に作用してがんを抑制する方向で働きます。
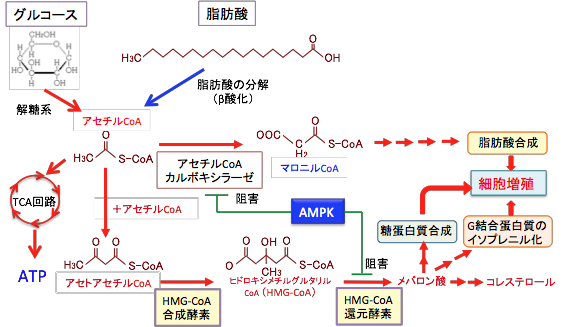
2)AMPKは脂肪酸やコレステロールの合成に必要なacetyl-CoA carboxylase (ACC)とHMG-CoA還元酵素(3-hydroxy-3-methylglutaryl-CoA reductase)の活性を阻害します。ACCの阻害によって脂肪酸の合成が阻害されると増殖が抑制されます。 HMG-CoA還元酵素は、コレステロールやイソプレノイドを合成するメバロン酸経路の律速酵素の一つで、この酵素の阻害剤はスタチン (Statin)として知られ、コレステロール降下剤として広く用いられています。AMPKはスタチンと同じようにHMG-CoA還元酵素を阻害して、メバロン酸の合成を阻害します。メバロン酸はコレステロールの合成に必要なだけでなく、糖たんぱくの合成や、GTP結合タンパク質(Gタンパク質)のイソプレニル化に必要な物質(geranylpyrophophateやfarnesylpyrophosphate)を作ります。したがって、メバロン酸経路が阻害されると、がん細胞の増殖は抑えられことになります。
図:グルコース(ブドウ糖)や脂肪酸が分解して生成されるアセチルCoAはTCA回路でATP産生に使われ、さらに、脂肪酸やメバロン酸やコレステロールの合成に使用される。
GTP結合タンパク質はイソプレニル化を受けた後に細胞膜に移行することで、細胞増殖のスイッチをオンにする。HMG-CoA還元酵素を阻害してイソプレノイド生成が低下すると、がん細胞の増殖活性が低下する。がん細胞では、脂肪酸合成酵素やアセチルCoAカルボキシラーゼなど脂肪酸やメバロン酸の合成に関与する酵素の活性が高くなっていることが知られている。AMPKはアセチルCoAカルボキシラーゼとHMG-CoA還元酵素を阻害して、がん細胞の増殖を阻害する。3)AMPKは嫌気性解糖系を阻害します。がん細胞では、嫌気性解糖系が亢進しており、ワールブルグ効果として知られています。がん細胞の嫌気性解糖系を阻害することはがん細胞の増殖抑制に有効です。
4)AMPKはmTORC1(mammalian target of rapamycin complex 1)経路を阻害して蛋白質の合成を抑制し、がん細胞の増殖や血管新生を阻害します。 mTORC1はラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。mTORC1の活性を阻害すると、がん細胞の増殖や血管新生を阻害することができます。mTOR阻害剤ががんの治療薬として臨床ですでに使用されています。
AMPKの活性化ががんの発生率を低下させ、がん治療の効果を高めることが報告されています。AMPKを活性化する薬として糖尿病治療薬のメトホルミン(Metformin)があります。
【mTORC1(哺乳類ラパマイシン標的蛋白質複合体1)の活性阻害はがん細胞の増殖を抑制する】
ラパマイシン(Rapamycin)は1970年代にイースター島の土壌から発見されたStreptomyces hygroscopicsという放線菌の一種が産生するマクロライド系物質(大環状のラクトンを有する有機化合物)で、免疫抑制剤として臓器移植の拒絶反応を防ぐ薬として使用されています。 イースター島はポリネシア語で「ラパ・ヌイ(Rapa Nui)」と言い、この「ラパ」と「菌類が合成する抗生物質」を意味する接尾語の「マイシン」とを組み合わせて「ラパマイシン」と名付けられています。
ラパマイシンの薬効としては、免疫抑制作用の他に、平滑筋細胞増殖抑制作用や抗がん作用や寿命延長効果が知られています。 平滑筋細胞増殖抑制作用に関しては、狭心症や心筋梗塞の治療に使われる血管内ステントに冠動脈再狭窄予防効果を目的としてラパマイシンを配合したステントが製品化され、心臓カテーテル治療において使用されています。また、リンパ脈管筋腫症の治療薬としても使用されています。 寿命延長作用については、生後600日のマウス(人間では60歳ほどに相当)にラパマイシンを投与すると、通常に比べてメスは平均で13%、オスは9%長生きしたという動物実験の結果が報告されています。 ラパマイシン自体に抗がん作用が報告されていますが、ラパマイシンの構造を改変した物質(ラパマイシン誘導体)が抗がん剤として開発されて、すでに幾つかの薬が臨床で使用されています。
このようなラパマイシンの多彩な薬効は、細胞の増殖やエネルギー産生に重要な役割を担っている細胞内蛋白質に作用することによって発揮されます。このラパマイシンがターゲットにする蛋白質が哺乳類ラパマイシン標的タンパク質(mammalian target of rapamycin)、略してmTOR(エムトール)という蛋白質です。
mTORはラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。初め、酵母におけるラパマイシンの標的タンパク質が見出されてTOR(target of rapamycin)と命名され、後に哺乳類のホモログが見出されてmTORと命名されました。
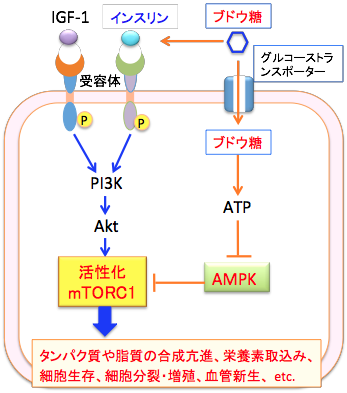
mTORにはmTOR複合体1((mammalian target of rapamycin complex 1:mTORC1)とmTOR複合体2((mammalian target of rapamycin complex 2:mTOR2)の2種類があります。 mTORC1は成長因子や、糖やアミノ酸などを含む栄養素のセンサーとして機能し、mTORC2は細胞骨格やシグナル伝達の制御をしています。 インスリンやインスリン様成長因子が刺激するのはmTORC1の方です。
mTORC1は、糖やアミノ酸などの栄養素の状況、エネルギー状態、成長因子(増殖因子)などによる情報を統合し、エネルギー産生や細胞分裂や生存などを調節しています。すなわち、細胞内の栄養やエネルギー環境の変動によって活性が制御され、シグナル伝達の下流に存在する様々なキナーゼ(タンパク質リン酸化酵素)などを介して、タンパク質の合成やエネルギー産生、細胞増殖など様々な細胞内の反応に関与しています。
mTORC1を活性化するシグナル伝達経路の代表は、インスリンやインスリン様成長因子などの成長因子の受容体から惹起されるPI3K-AKTシグナル伝達系です。すなわち、細胞が増殖因子などで刺激を受けるとPI3キナーゼ(Phosphoinositide 3-kinase:PI3K)というリン酸化酵素が活性化され、これがAktというセリン・スレオニンリン酸化酵素をリン酸化して活性化します。活性化したAktは、細胞内のシグナル伝達に関与する様々な蛋白質の活性を調節することによって細胞の増殖や生存(死)の調節を行います。このAktのターゲットの一つがmTORC1です。
Aktによってリン酸化(活性化)されたmTORC1はタンパク質や脂質の合成や細胞分裂や細胞死や血管新生やエネルギー産生などに作用してがん細胞の増殖を促進します。 この経路をPI3K/Akt/mTORC1経路と言い、がん細胞や肉腫細胞の増殖を促進するメカニズムとして極めて重要であることが知られています。
すなわち、PI3K/Akt/mTORC1経路の阻害はがん細胞や肉腫細胞の増殖を抑制し、細胞死(アポトーシス)を誘導することができるため、がん治療のターゲットとして注目されています。PI3K/Akt/mTORC1経路の阻害は、抗がん剤や放射線治療の効き目を高める効果も報告されています。AMPKはmTORC1の活性を阻害して抗がん作用を発揮します。
図:mTORC1(mammalian target of rapamycin complex-1:哺乳類ラパマイシン標的蛋白質複合体-1)はインスリンやインスリン様成長因子-1などによって活性化される。活性化されたmTORC1はシグナル伝達の下流に存在する様々なキナーゼ(タンパク質リン酸化酵素)などを介してタンパク質合成や細胞分裂を促進し、その結果がん細胞の増殖を促進する。PI3K/Akt/mTOR経路の阻害はがん細胞や肉腫細胞の増殖を抑制し細胞死を誘導することができるため、がん治療のターゲットとして注目されている。AMP活性化プロテインキナーゼ(AMPK)を活性化するとmTORC1の活性化を抑えることができる。
【転写因子のFOXOの活性化はがん細胞の増殖を抑制する】
FOXOは「Forkhead box O」の略で、DNA結合ドメインFOX(Forkhead box)をもつForkheadファミリーのサブグループ“O”に属する転写因子です。哺乳類ではFOXO1,3,4,6の4種類が存在、線虫ではDaf-16、ショウジョウバエではdFOXOとそれぞれ1種類のみ存在し、栄養飢餓時に活性化される転写因子です。
FOXO1とFOXO3は約650個のアミノ酸からなる蛋白質で、遺伝子のプロモーター領域のTTGTTTACという配列に結合 します。アンドロゲン受容体やβカテニンとも相互作用します。
転写因子というのは特定の遺伝子の発現(DNAの情報を蛋白質に変換すること)を調節している蛋白質で、FOXOはストレス応答、代謝制御、細胞周期、アポトーシス、DNA修復などに関連する多くの遺伝子の発現誘導を促します。がん抑制遺伝子としての性格ももっており、FOXOの活性化は抗がん作用があります。
FOXOは様々なストレスに対する抵抗力を高める作用を担っており、カロリー制限における寿命延長や老化性疾患の抑制において重要な役割を果たしていることが知られています。
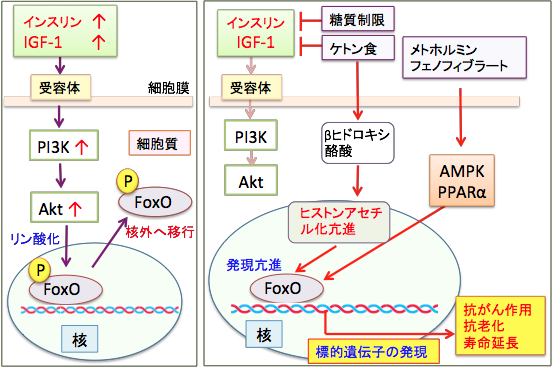
FOXOはインスリン-PI3K-Aktシグナルによって負に制御されています。つまり、PI3K-Aktシグナルが活性化されるとAktによって直接的にリン酸化され、FOXOの核外移行を促進することでその転写活性は抑制されます。一方、栄養飢餓状態ではPI3K-Aktの不活性化に伴いFOXOの活性化が誘導されることになります。つまり、カロリー制限や糖質制限やAMPK活性化などによる寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています。
脂肪酸のβ酸化の亢進やケトン体のβヒドロキシ酪酸がFOXOを活性化することが知られています。ペルオキシソーム増殖因子活性化受容体α(PPARα)のリガンドであるフェノフィブラートがFOXOの活性を亢進することが報告されています。
図:インスリンやインスリン様成長因子1 (IGF-1)による増殖刺激によって、がん細胞はPI3K/Aktシグナル伝達系のタンパク質がリン酸化されて活性化されると増殖や転移が促進される。転写因子FOXOはAktによってリン酸化されると核外に移行するので、転写活性が阻害される(左図)。 したがって、Aktを不活性化してFOXOのリン酸化を阻害すれば、FOXOの活性が高まる。FOXOによって発現が亢進される標的遺伝子には、がん細胞の増殖抑制やアポトーシス誘導や血管新生阻害に関わる遺伝子があり、FOXOの活性化はがん細胞の増殖や転移を抑制する。抗老化や寿命延長効果もある。AMPKを活性化するメトホルミンやケトン食で増えるβヒドロキシ酪酸 やPPARα(ペルオキシソーム増殖因子活性化受容体α)のリガンドであるフェノフィブラートはFOXOの活性を亢進する(右図)。
【メトホルミンの抗がん作用】
メトホルミンは2型糖尿病の治療薬(ビグアナイド系経口血糖降下剤)ですが、がんの予防や治療の分野でも注目されており、がん予防効果やがん細胞の抗がん剤感受性を高める効果などが数多くの論文で報告されています。
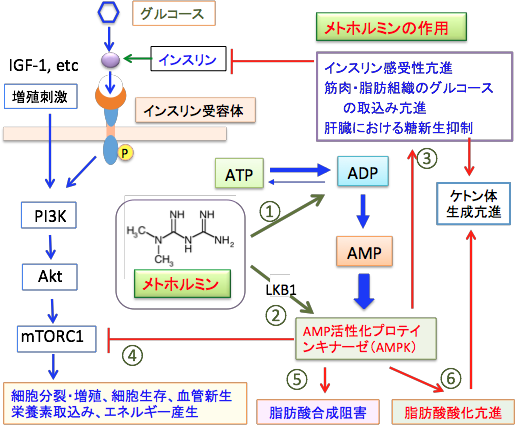
メトホルミンは、AMP活性化プロテインキナーゼ(AMPK)を介した細胞内信号伝達系を刺激することによって糖代謝を改善します。すなわち、筋・脂肪組織においてインスリン受容体の数を増加し、インスリン結合を増加させ、インスリン作用を増強してグルコース取り込みを促進します。さらに肝臓に作用して糖新生を抑え、腸管でのブドウ糖吸収を抑制する作用があります。これらの作用はインスリンの血中濃度を低下させます。インスリンはがん細胞の増殖を促進するので、インスリンの血中濃度を減らすだけで、がん細胞の増殖を抑制する効果があります。
さらに、AMPKはインスリンおよびインスリン様成長因子-1(IGF-1)によって活性化されるPI3K/Akt/mTORシグナル伝達系のmTORC1(哺乳類ラパマイシン標的タンパク質複合体1: mammalian target of rapamycin omplex 1)の活性を阻害します。また、HMG-CoA還元酵素とアセチルCoAカルボキシラーゼを阻害することによって脂質合成を阻害します。
これらの総合的な作用によってメトホルミンはがんの発生や増殖を抑制する効果があると考えられています。最近の研究では、メトホルミンが抗がん剤治療や放射線治療の効果を高めることが報告されています。特に、がん幹細胞の抗がん剤感受性を高める効果が多数報告されています。
インスリン抵抗性を改善することは老化やがんの予防に有効であることが明らかになっており、メトホルミンはがん予防や抗老化の薬としても注目されるようになっています 。
図:メトホルミンは、ミトコンドリアの酸化的リン酸化を阻害してATPを減少させる作用(①)と、LKB1(liver kinase B1)を活性化する作用(②)でAMPKを活性化する。AMPKは肝臓の糖新生を抑制し、筋肉や脂肪細胞のグルコースの取込みを促進し、細胞のインスリン感受性を高めてインスリン濃度を減少させる(③)。AMPKはインスリンおよびインスリン様成長因子-1(IGF-1)によって活性化されるPI3K/Akt/mTORC1シグナル伝達系のmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)の活性を阻害する(④)。AMPKはHMG-CoA還元酵素とアセチルCoAカルボキシラーゼを阻害して脂質合成を阻害し(⑤)、脂肪酸のβ酸化を亢進してケトン体の産生を高める(⑥)。
【βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害して、ヒストンのアセチル化を亢進する】
βヒドロキシ酪酸はケトン体の一種です。ケトン体は絶食などで糖質が枯渇した状態で脂肪酸の燃焼(β酸化)が亢進したときに肝臓で産生され、グルコース(ブドウ糖)が枯渇した時の代替エネルギーになります。絶食時などで日常的に産生されています。
ケトン体としてアセト酢酸、βヒドロキシ酪酸、アセトンの3種が作られますが、アセトンは呼気となって排泄され、アセト酢酸とβヒドロキシ酪酸はエネルギー源になります。
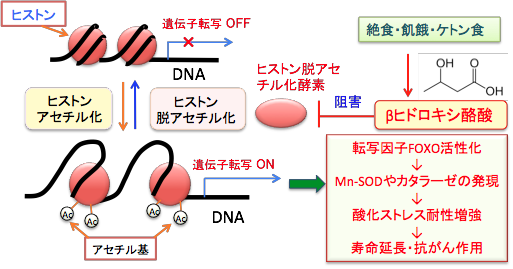
最近の論文で、「βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害し、酸化ストレス耐性遺伝子の発現を亢進させ、酸化ストレスを抑制する」ことが示されています。(Science 339(6116): 211-4, 2013年)
この論文で以下のような結果が得られています。
1)培養細胞やマウスの動物実験でβヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素を阻害する。
2)飢餓や直接βヒドロキシ酪酸を投与する方法でマウスの血中のβヒドロキシ酪酸の濃度(0.6~1.5mM)を上昇させると、腎臓など複数の臓器においてヒストンのアセチル化が増えていることが確認できた。
3)βヒドロキシ酪酸によって発現が亢進する遺伝子として、細胞周期の停止や酸化ストレス耐性にかかわる転写因子をコードしているFOXO3a遺伝子や、酸化ストレス耐性遺伝子のMt2が同定された。つまり、βヒドロキシ酪酸はクラスIヒストン脱アセチル化酵素を阻害することによってFOXO3aやMt2などの酸化ストレス耐性遺伝子のプロモーターにおけるヒストンの高アセチル化を引き起こしていると考えられた。
4)酸化ストレス耐性に重要は働きを果たしているMnスーパーオキシドジスムターゼおよびカタラーゼは転写因子FOXO3aの標的遺伝子である。βヒドロキシ酪酸の投与によって、マウスの腎臓において、FOXO3aのみならず、Mnスーパーオキシドジスムターゼとカタラーゼの発現量もタンパク質レベルで顕著に増加していた。
5)除草剤のパラコートをマウスに投与して酸化障害によるタンパク質のカルボニル化を測定すると、βヒドロキシ酪酸を投与されたマウスでは、酸化ストレスによって引き起こされるカルボニル化を顕著に抑制した。以上の結果から、βヒドロキシ酪酸は内在性のヒストン脱アセチル化酵素を阻害し、酸化ストレスに対して抵抗性を高める遺伝子のプロモーター部分におけるヒストンの高アセチル化を引き起こし、これらの遺伝子発現を亢進することによって酸化ストレスを軽減するということが証明されたということです。
酸化ストレスに対する抵抗性の亢進は寿命延長やがん抑制に有効であることが明らかになっています。さらに、ヒストン脱アセチル化酵素の阻害が、寿命の延長やがん細胞の分化誘導や増殖抑制に効果があることも多くの研究で明らかになっています。つまり、絶食やケトン食による健康作用や寿命延長作用や抗がん作用の一部は、βヒドロキシ酪酸によるヒストン脱アセチル化酵素の阻害作用が関与している可能性を示唆しています。
ケトン食は成長ホルモン/インスリン様成長因子-1のシグナル伝達系に抑制的に作用することが明らかになっています。さらに、ヒストンのアセチル化による寿命延長と抗がん作用も加わります。糖質を制限し、脂肪酸の燃焼を増やし、ケトン体を多く出させる中鎖脂肪ケトン食が、美容と寿命延長と抗がん作用を同時に達成できることを示す科学的エビデンスが増えています。
図:絶食や飢餓やケトン食によってβヒドロキシ酪酸の濃度が上昇すると、ヒストン脱アセチル化酵素が阻害される。これによって遺伝子プロモーター領域のヒストンが高アセチル化し、転写因子FOXOが活性化され、Mnスーパーオキシドジスムターゼ(Mn-SOD)やカタラーゼの発現を誘導し、酸化ストレスに対して耐性が増強する。
【αリポ酸はサーチュイン1の発現を誘導し、AMPKを活性化する】
AMP活性化プロテインキナーゼ(AMPK)を活性化する酵素の一つがLiver Kinase B1(LKB1)です。LKB1はセリン・スレオニンキナーゼで、AMPKをリン酸化して活性化します。
AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化されます。
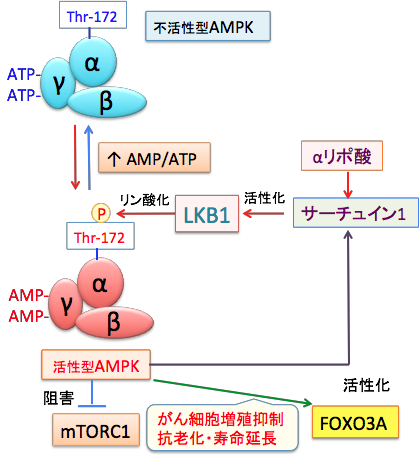
AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在します。γサブユニットにはATPが結合していますが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わります。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2~10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化されます。
リン酸化されたAMPKはmTORC1を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制します。また、転写因子のFOXO3Aを活性化して抗酸化力やストレスに対する抵抗力を高め、抗老化や寿命延長効果を発揮します。
つまり、LKB1はAMPKを活性化する作用によってがん細胞の増殖を抑制する作用があるがん抑制遺伝子と言えます。AMP/ATP比を上昇させてAMPKを活性化するメトホルミンががん予防効果や抗がん作用を示す主要なメカニズムがAMPKの活性化です。
αリポ酸がサーチュイン1の発現を誘導し、LKB1を活性化してAMPKを活性化する作用が報告されています。
寿命を延ばす確実な方法としてカロリー制限があります。カロリー制限は、栄養不良を伴わない低カロリー食事療法で、霊長類を含む多岐にわたる生物種において老化を遅延させ、寿命を延長させることが知られています。このカロリー制限のときに活性化されて寿命延長と抗老化作用に関与するのがサーチュイン遺伝子です。つまり、サーチュイン遺伝子が活性化されると老化が抑制されることになります。
サーチュインがAMPKの上流に位置するリン酸化酵素であるLKB1を脱アセチル化し、AMPKを活性化します。AMPKが活性化すると、AMPKは細胞内NAD+を増加させることでさらにサーチュイン活性が促進し、自ら活性が増強するループを形成しているという報告があります。
サーチュイン遺伝子やAMP活性化プロテインキナーゼの活性化はがん細胞の増殖を抑制する作用を持ちます。
AMPKの活性化は、細胞内の脂肪酸のβ酸化を亢進し、脂質合成に関与するアセチル-CoAカルボキシラーゼ(ACC)と脂肪酸合成酵素(FAS)の活性を阻害します。脂肪酸の合成が阻害され、β酸化が亢進するとがん細胞は増殖が阻害されます。
αリポ酸は抗酸化作用やグルコース代謝を促進する(αリポ酸はピルビン酸をアセチルCoAに変換するピルビン酸脱水素酵素の補酵素)作用が主体ですが、さらにSIRT1とAMPKを活性化して、脂肪酸のβ酸化を亢進して脂肪酸合成を阻害する作用もαリポ酸の抗腫瘍作用のメカニズムになっていると思われます。
αリポ酸はサーチュイン1とAMPKを活性化する効果があるので、ケトン食に併用すると、脂肪酸のβ酸化とケトン体産生の亢進に役立ちます。
図:AMP活性化プロテインキナーゼ(AMPK)はα, β, γの3つのサブユニットからなるヘテロ三量体で、ATPが減少してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置換する。これによってAMPKの構造変化が起こると、LKB1というリン酸化酵素の親和性が高まり、αサブユニットのスレオニン172がリン酸化されると、さらにAMPKの活性が高まる。活性化したAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を阻害し、転写因子のFOXO3Aを活性化し、その他様々な機序で、がん細胞の増殖を抑制し、抗老化や寿命延長の効果を引き起こす。
αリポ酸はサーチュイン1の発現を誘導し、サーチュイン1はLKB1を脱アセチル化して活性化し、さらにAMPKを活性化する。
【アディポネクチンとカルモジュリン依存性プロテインキナーゼ・キナーゼによるAMPK活性化】
肺がんや子宮内膜がんなど多くのがんでLKB1遺伝子の変異が認められ、機能が失活しています。つまり、LKB1遺伝子に変異がある場合は、メトホルミンやαリポ酸のAMPK活性化による抗腫瘍効果は期待できないことになります。
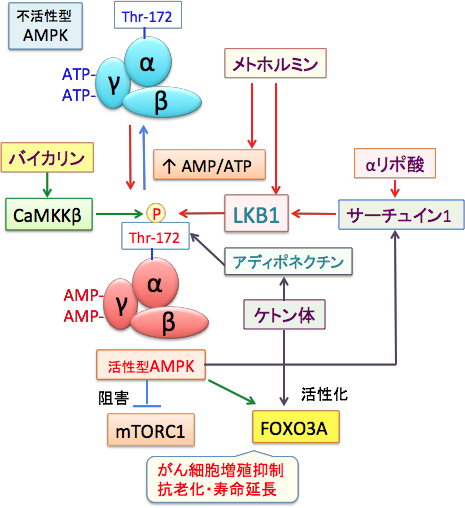
そこで、LKB1以外のルートでのAMPKの活性化ががん治療において重要になってきます。LKB1以外では、アディポネクチン (Adiponectin)やカルモジュリン依存性プロテインキナーゼ・キナーゼβ (CaMKKβ)を介したシグナル伝達もまた、AMPKの活性化にとって重要であることが示されています。
アディポネクチンは脂肪細胞から分泌される善玉ホルモンのような蛋白質で、肝臓や筋肉細胞のアディポネクチン受容体に作用してAMP活性化プロテインキナーゼ(AMPK)を活性化し、インスリン抵抗性を改善し、動脈硬化や糖尿病を防ぐ作用があります。さらに、がん細胞におけるAMPKの活性化は様々な抗がん作用を発揮します。
アディポネクチンは血中に1分子ずつバラバラにではなく、複数個がくっついた形で存在しています。低分子量(3量体)、中分子量(6量体)、高分子量(12~18量体)です。中でも高分子量アディポネクチンが生理活性が強いことが知られています。
アディポネクチンには、がん細胞の増殖や転移の抑制など様々な抗がん作用があることが報告されています。人の胃がん細胞を移植したマウスにアディポネクチンを注射すると、がんが著しく縮小したという報告があります。
ケトン食で高分子量アディポネクチンの値が増加する結果が臨床試験で得られています。この場合、低カロリー食では有意な上昇を認めず、ケトン食でのみ増加が認められたことから、ケトン体に高分子量アディポネクチンを増やす効果があるようです。
また、ラットを使った実験で、ケトン食が、脂肪組織におけるアディポネクチンmRNAの量を増やすことが報告されています(J Clin Neurosci. 2010 Jul;17(7):899-904. )
ケトン食は、がん細胞へのブドウ糖(グルコース)の供給を減らし、さらにインスリンやインスリン様成長因子の産生を減らすことによって増殖シグナルを低下させるメカニズムなどによって抗がん作用を発揮します。さらに、ケトン食が寿命延長作用と抗がん作用のある高分子量アディポネクチンの産生を増やすという臨床試験の結果は、ケトン食の抗がん作用をさらに支持することになります。
生薬の黄芩(オウゴン)に含まれるバイカリンがCa2+/CaMKKβ依存性の経路を活性化してAMPKを活性化することが報告されています。(PLoS One. 2012; 7(10): e47900. )
CaMKKβはAMPKの上流に位置するキナーゼ(リン酸化酵素)として作用しています。
黄芩(オウゴン)はシソ科のコガネバナ(Scutellaria baicalensis)の根で、抗菌作用や抗炎症作用や抗がん作用があります。フラボノイドのバイカリンやバイカレインやオウゴニンなどが含まれ、その抗炎症作用や抗がん作用に関する研究は数多くあります。がんの漢方治療でも使用頻度の高い生薬です。
生薬に多く含まれるオレアノール酸がAMPKを活性化しさらにFOXO3Aを活性化する作用が報告されています。(Int J Physiol Pathophysiol Pharmacol. 2009 Mar 25;1(2):116-126.)
オレアノール酸は白花蛇舌草などの抗がん生薬に多く含まれています。
以上のように、ケトン食や黄芩や白花蛇舌草などを多く用いた漢方薬を併用すると、LKB1に変異があるがん細胞にもAMPKを活性化できることになります。
図:がん細胞ではLKB1が変異していることがあり、この場合は、αリポ酸やメトホルミンによるがん細胞内でのAMPKの活性化が起こりにくい。LKB1を介さないでAMPKを活性化する方法としてカルモジュリン依存性プロテインキナーゼ・キナーゼβ (CaMKKβ)やアディポネクチン (Adiponectin)を介したシグナル伝達がある。生薬の黄芩に含まれるバイカリンというフラボノイドがCaMKKβを活性化してAMPKを活性化するという報告がある。また、ケトン食がアディポネクチンを増やすという報告もある。したがって、ケトン食に、αリポ酸やバイカリンを含む漢方薬やメトホルミンを併用すると、LKB1遺伝子に変異のあるがん細胞も含めてAMPKを効率的に活性化して抗がん作用を増強できる可能性がある。
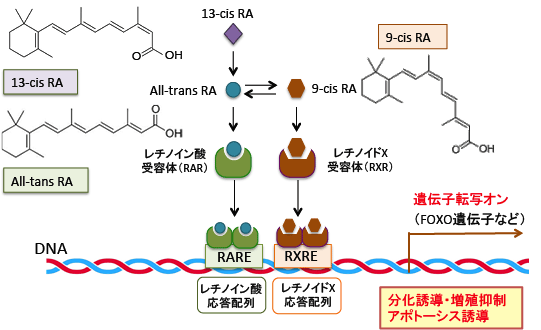
【レチノイドは遺伝子の発現を調節する】
レチノイド(retinoid)はビタミンA(レチノール)およびその誘導体や類縁化合物の総称です。レチノイドは生体内では活性型であるAll-trans retinoic acid (ATRA:以下レチノイン酸)として細胞核内の受容体に結合して、その生理作用を発揮します。
レチノイン酸の核内受容体には、レチノイン酸受容体(retinoic acid receptor: RAR)とレチノイドX受容体(retinoid X receptor: RXR)があり、それぞれα、β、γのサブタイプが存在します。
これらの受容体はリガンドの結合刺激によりホモ二量体(RAR-RARやRXR-RXR)を形成しますが、RXRはRXRとのホモ二量体だけでなく、RARやビタミンD受容体などの核内受容体とのヘテロ二量体(RAR-RXR)も形成します。
そして、これらの二量体は標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列(retinoic acid response element: RARE)あるいはレチノイドX応答配列(retinoid X response element: RXRE)と結合することによって、様々な標的遺伝子の発現を調節しています。
異性体の関係にあるAll-trans-RA (ATRA) と 9-cis-RA (9C-RA)は2つともRARのリガンドになりますが、RXRのリガンドとなるのは9C-RAのみです。
レチノイドによって発現が調節される遺伝子は細胞の分化や増殖や死(アポトーシス)の制御に重要は働きを担っているため、その機能異常は細胞のがん化に関連し、ある種のがんに対してレチノイドが効く場合があります。
例えば、レチノイン酸の二重結合がすべてトランス型になったall-trans retinoic acid(ATRA)は急性前骨髄球性白血病の特効薬になっています。また、RXRαのアゴニストとして合成された非環式レチノイドが肝臓がんの再発を予防する効果が報告されています。ある種のがんにはレチノイドは増殖抑制や分化誘導やアポトーシス誘導などの抗がん作用を示します。
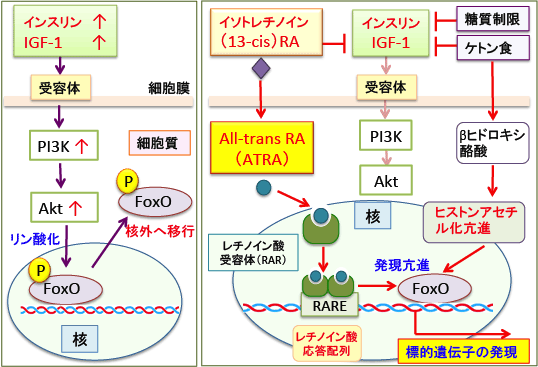
難治性にきびの治療に用いられている13-cisレチノイン酸(イソトレチノイン)は、にきびに対する作用機序において、IGF-1産生抑制作用や転写因子のFOXOを活性化する作用などが報告され、また、単独では抗腫瘍効果は弱いのですが、他の治療との組合せで抗腫瘍効果が高まることが報告されています。13-cisレチノイン酸は体内でAll-trans レチノイン酸に変換されて効果を発揮します。
図:ビタミンAの体内における活性本体であるAll-trans retinoic acid(レチノイン酸)はレチノイン酸受容体(retinoic acid receptor: RAR)に結合するとホモ二量体を形成し、標的遺伝子のプロモーター領域にあるレチノイン酸応答配列(RARE)に結合して遺伝子転写のスイッチをオンにする。レチノイン酸の異性体である9-cis retinoic acidはレチノイン酸受容体(RAR)の他にレチノイドX受容体(RXR)にも結合して、ホモ二量体やヘテロ二量体を形成して細胞核内の受容体に結合して標的遺伝子の転写を誘導して生理機能を発揮する。13-cis retinoic acid(イソトレチノイン)はプロドラッグであり、細胞内でAll-trans RAに変換されて、同様の遺伝子発現の調節を行う。
【イソトレチノイン(13-cisレチノイン酸)は転写因子FOXOの発現を亢進する】
成長期の子供がイソトレチノイン(13-cis retinoic acid)を服用すると、成長が止まることが報告されています。その理由として成長ホルモンやインスリン様成長因子-1への作用が指摘されています。イソトレチノインがインスリン様成長因子-1(IGF-1)の血中濃度を低下させる作用が報告されています。
例えば、47人のにきび患者(平均年齢21.5±5.1歳)を対象に、イソトレチノインの1日量を最初の1ヶ月間は0.5〜0.75mg/kgで開始し、その後維持量として0.88 mg/kgで治療を行っています。3ヶ月後に採血して検討したところ、インスリン様成長因子-1とインスリン様成長因子結合蛋白-3の血中濃度が著明に低下していました。(Br J Dermatol 162(4): 798-802, 2010年)
イソトレチノインは小児の腫瘍の神経芽細胞腫(neuroblastoma)の治療に効果があります。この神経芽細胞腫の治療に13-cisレチノイン酸を使った小児の成長が抑制されたという報告があります。(Endocr J. 46 Suppl:S113-5, 1999年)
イソトレチノインはIGF-1シグナル伝達系を抑制的に作用するようです。
イソトレチノインがFOXO1とFOXO3aの活性を高めることが報告されています(イソトレチノインはFOXO3aの活性を高め、FOXO3aがFOXO1の転写を亢進します)。(G Ital Dermatol Venereol. 145(5):559-71. 2010年)
図:(左)インスリン/インスリン様成長因子-1(IGF-1)はPI3K/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FoxOをリン酸化する。リン酸化されたFoxOは核外(細胞質)へ移行するので、FoxOの転写活性は抑制される。
(右)イソトレチノイン(13-cis retinoic acid)は細胞内でAll-transレチノイン酸
(ATRA)に変換され、レチノイン酸受容体に結合し二量体を形成して標的遺伝子のプロモーター部分のレチノイン酸応答配列(RARE)に結合して遺伝子発現を亢進する。イソトレチノインはIGF-1の産生を抑制する作用がある。さらに、糖質制限はインスリン濃度を低下させ、ケトン食はIGF-1濃度を低下させると同時に、ヒストン脱アセチル化酵素を阻害してヒストンのアセチル化を亢進してFoxO遺伝子の発現を亢進する作用もある。したがって、ケトン体を多く産生する中鎖脂肪ケトン食とイソトレチノインは転写因子のFoxOの活性化などによって相乗効果で抗がん作用を強めることができる。
【ヒストンのアセチル化促進作用とイソトレチノインの相乗効果】
13-cisレチノイン酸(イソトレチノイン)は体内でall-transレチノイン酸(ATRA)に変換され、ATRAは細胞核内のレチノイン酸受容体(retinoic acid receptor:RAR)やレチノイドX受容体(retinoid X receptor: RXR)に結合して2量体を形成して、標的遺伝子のプロモーター領域に存在するレチノイン酸応答配列(retinoic acid response element: RARE)あるいはレチノイドX応答配列(retinoid X response element: RXRE)と結合することによって、様々な標的遺伝子の発現を調節しています。
にきびの治療にはイソトレチノインは劇的に効きます。がんに対する効果も期待されて多くの臨床試験が行われたのですが、あまり良い結果は得られなかったため、次第に注目されなくなっています。
ただ、がん細胞の遺伝子にはエピジェネティックは制御が起こっています。特に細胞増殖を抑制したり細胞死や分化を誘導するようながん抑制遺伝子には、DNAのアセチル化やヒストンの脱アセチル化によって転写因子がアクセスできにくくなっていることが明らかになっています。つまり、レチノイドが思うように効かないのは、これらの遺伝子にレチノイドがアクセスできないためで、アクセスできるようすればレチノイドの抗がん作用が出てくる可能性があります。
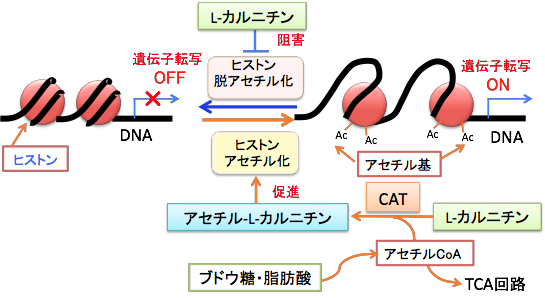
中鎖脂肪ケトン食は、糖質と極力摂取しないので、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系を抑制し、ケトン体のβヒドロキシ酪酸は、ヒストン脱アセチル化酵素を阻害することによって、ヒストンの高アセチル化によってFOXO遺伝子などのがん抑制作用のある遺伝子の発現を促進します。ヒストンのアセチル化によって転写因子がアクセスしやすくなると、レチノイドの遺伝子発現誘導作用も促進されます。つまり、にきび治療薬の13-cisレチノイン酸(イソトレチノイン)を併用するとFOXO遺伝子の発現と転写活性を高めることができます。さらに、脂肪酸の燃焼を促進してケトン食の効果を高めるL-カルニチンにはヒストンのアセチル化を高めて、がん細胞の増殖を抑制することが示されています。すなわち、L-カルニチンは内因性のヒストン脱アセチル化酵素の阻害剤で、生体内でがん細胞の増殖を選択的に阻害することが報告されていま。(PLoS One. 2012; 7(11): e49062.)
さらに、L-カルニチンにアセチル基(CH3CO-)が結合したアセチル-L-カルニチンはヒストンアセチル化のアセチル基を供給する作用があります。
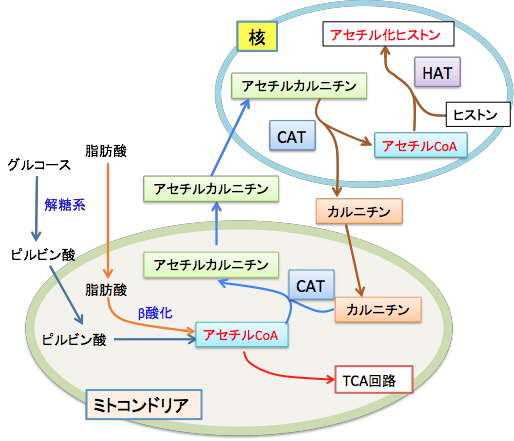
ミトコンドリアで生成されたアセチルCoAは、カルニチン・アシルカルニチン・トランスロカーゼ(carnitine acylcarnitine translocase)の作用で細胞質に運ばれ、ついで細胞核に運ばれ、核でカルニチン・アセチルトランスフェラーゼ(carnitine acetyltransferase)によってアセチルCoAに変換され、ヒストンのアセチル化のアセチル基の供給源となることが報告されています。(Epigenetics 4(6):399-403, 2009年)アセチル-CoAはグルコース(ブドウ糖)や脂肪酸の分解で生成されます。すなわち、グルコースが解糖系で代謝されてピルピン酸が作られ、ピルビン酸がミトコンドリアに入って、ピルビン酸脱水素酵素の働きでアセチル-CoAに変換されてTCA回路に入ります。脂肪酸もミトコンドリアでβ酸化によって分解されてアセチル-CoAに変換されTCA回路に入ります。このとき、グルコースが枯渇しているとアセチル-CoAは肝臓でケトン体生成に使われます。
グルコース枯渇時にアセチル-CoAがケトン体に変換されるのは、アセチル-CoAが細胞膜を通れないので、細胞膜を通過できるケトン体に変換されて脳などの他の組織の細胞にエネルギー産生の原料として運ばれるためです。
細胞核におけるヒストンのアセチル化では、アセチル-CoAのアセチル基が使われますが、このアセチル-CoAはミトコンドリアで作成され、ミトコンドリアから核への運搬にはL-カルニチンが必要ということです。この経路をまとめると以下のようになります。
図:グルコースや脂肪酸の分解によって産生されたミトコンドリア内のアセチル-CoAは、カルニチンアセチルトランスフェラーゼ(CAT)の作用により、L-カルニチンと結合してアセチル-L-カルニチンとしてミトコンドリア外の細胞質に輸送され、さらに細胞核に移行する。核に移行したアセチル-L-カルニチンは、L-カルニチンとアセチル-CoAに分解され、アセチル-CoAはヒストンアセチルトランスフェラーゼ(HAT)の作用によってヒストンをアセチル化する。
図:L-カルニチンにはヒストン脱アセチル化酵素阻害作用によってヒストンのアセチル化のレベルを高める。さらにL-カルニチンはアセチル-L-カルニチンとしてミトコンドリアで生成されたアセチルCoAを核に運ぶ役割も担っている。核ではアセチルCoAのアセチル基をヒストンアセチル基転移酵素の働きでヒストンをアセチル化する。つまり、L-カルニチンとアセチル-L-カルニチンは、ヒストンのアセチル化を促進する。
緑茶に含まれるエピガロ・カテキン・ガレート(EGCG)が、がん抑制遺伝子のDNAのメチル化を阻害してがん抑制遺伝子の働きを高めることが報告されています。EGCGのがん予防効果は今まで主に抗酸化作用によるものと考えられてきましたが、DNAメチル化の阻害でがん抑制遺伝子の活性を高める作用も関与しているかもしれないということです。その他、ウコンのクルクミンや、赤ぶどうの皮に含まれるレスベラトロール、アブラナ科野菜のスルフォラファン、大豆のゲニステインなど、がん予防効果が報告されている様々な成分についても、DNAメチル化やヒストンのアセチル化の調節などエピジェネティクスに作用する結果が報告されています。
さらに、AMP依存性プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白複合体-1)メトホルミン、シリマリン、ジインドリルメタンなどの併用は、抗がん作用を強化できます。
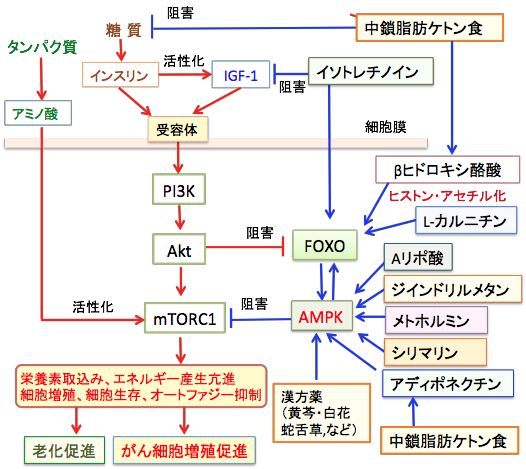
図:中鎖脂肪ケトン食は糖質摂取が少ないため、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系を抑制する。ケトン体のβヒドロキシ酪酸とL-カルニチンはヒストンの高アセチル化を引き起こし、転写因子のFOXOの発現を亢進する。レチノイドのイソトレチノインはIGF-1の産生抑制とFOXO発現を亢進する。
ケトン食はアディポネクチンの産生を高めてAMPKの活性を亢進する。メトホルミン、ジインドリルメタン、シリマリン、αリポ酸、漢方薬もAMPKを活性化する。AMPKの活性化はmTORC1の活性を阻害し、転写因子FOXOを活性化することによってがん細胞の増殖を抑制する。これらの相乗効果で抗がん作用を強めることができる。
●1ヶ月分の費用の目安 :
| メトホルミン:3000〜9000円 | L-カルニチン:6300〜12600円 |
| シリマリン:5000円 | ジインドリルメタン:9000円 |
| 漢方薬:2〜3万円 | フェノフィブラート;3000円〜6000円 |
| イソトレチノイン:3000円(1日10mg)〜 12000円(1日40mg) |