2-デオキシ-D-グルコース+メトホルミン+牛蒡子+糖質制限/ケトン食の抗がん作用
【2-デオキシ-D-グルコースはグルコース(ブドウ糖)の誘導体】
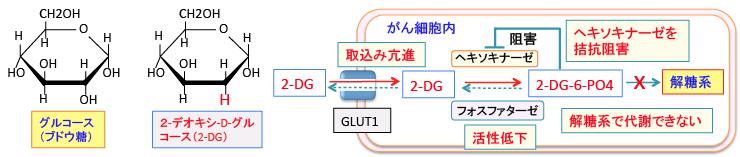
2-デオキシ-D-グルコース(2-Deoxy-D-glucose)は、グルコース(ブドウ糖)の2-ヒドロキシル基が水素原子に置換された物質(グルコース誘導体)です。2-デオキシグルコース(2-DG)はグルコースと同じようにグルコース輸送体(グルコース・トランスポーター)のGLUT1を利用して細胞内に取り込まれます。
グルコースと2-DGは細胞内に入るとヘキソキナーゼ(Hexokinase)によってリン酸化され、グルコース-6-リン酸あるいは2-デオキシ-D-グルコース-6-リン酸(2-DG-6-リン酸)に変換されます。リン酸化されるとグルコース・トランスポーター(GLUT1)を通過できないため細胞外へ出れなくなります。このヘキソキナーゼによる6位のリン酸化は解糖系によるグルコースの代謝の最初のステップで、細胞内に取込んだグルコースを細胞内にとどめておく目的があります。
リン酸化反応後は、グルコース-6-リン酸はさらに解糖系で代謝されてエネルギー産生に使われ、ペントース・リン酸経路で核酸などの物質合成の材料としても利用されます。
しかし、2-DG-6-リン酸は、解糖系酵素で代謝できないため、細胞内に蓄積します。グルコース-6-リン酸や2-DG-6-リン酸を脱リン酸化するフォスファターゼが糖新生を行う肝臓や腎臓の細胞にはありますが、多くのがん細胞はフォスファターゼの活性が低いので、一旦入った2DGは2DG-6-リン酸に変換されたあとは細胞外に出ることができず、さらにそれ以上代謝されることもできないので、2-DG-6-リン酸の状態でどんどん蓄積します。
2-DGによってエネルギー産生が低下するとそのストレス応答によってグルコーストランスポーターの発現がさらに増え、2-DGの取り込みをさらに増やすことにもなります。したがって、がん細胞は正常細胞に比べてより2-DGの取込みが増えます。細胞内で蓄積した2-DG-6-リン酸はヘキソキナーゼとヘキソース・フォスフェート・イソメラーゼを阻害します(拮抗阻害)。
したがって、2-DGを経口摂取すると、がん細胞に多く取り込まれ、がん細胞の解糖系を阻害するので、グルコースの代謝によるエネルギー産生と物質合成を阻害することになります。(下図)
図:2-デオキシ-D-グルコース(2-DG)はグルコース・トランスポーター(GLUT1)によって細胞内に取り込まれる。がん細胞はGLUT1の発現量が増え、グルコースと同時に2-DGも多く取り込む。2-DGはヘキソキナーゼで2-DG-6リン酸に変換されるが、それ以上代謝されない。がん細胞はフォスファターゼの活性が低いので、2-DG-6-リン酸ががん細胞内に蓄積する。2-DG-6-リン酸はヘキソキナーゼをフィードバック阻害するので、 2-DG-6-リン酸を取り込んだがん細胞はグルコースの解糖系での代謝が阻害される。その結果、がん細胞のエネルギー産生と物質合成は阻害されることになる。
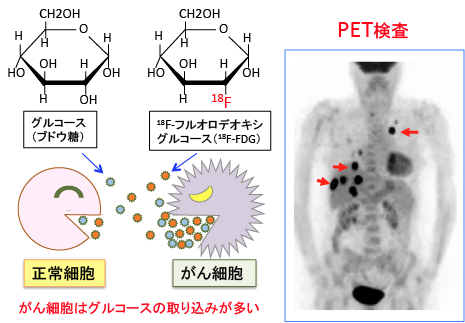
2-DGががん細胞内に多くトラップされることを利用した検査法がPETです。PETは「ポジトロン・エミッション・トモグラフィー(Positron Emission Tomography)」の略で、日本語では陽電子放射線断層撮影といいます。
2-DGの2位の水素原子(つまり、グルコースの2位のOH基)を陽電子放出同位体フッ素18(18F)で置換された18F-フルオロデオキシグルコース(FDG)という薬剤を注射した後、それをPET装置で撮影し、FDGの集まり方を画像化して診断するものです。
多くのがんは、グルコース取り込みおよびヘキソキナーゼレベルが上昇しているため、がん細胞にFDGが集まるのです。(下図)
図:18F-フルオロデオキシグルコース(18F-FDG)はグルコース(ブドウ糖)の2位の水酸基を陽電子(Positron)放出核種であるフッ素18で置換した誘導体。がん細胞は正常細胞の3〜8倍ものグルコースを取り込んで消費している。グルコースと同様に、がん細胞は18F-FDGの取り込みも多いので、18F-FDGを注射してがん組織を検出することができる。この検査を陽電子放出断層撮影(Positron Emission Tomography: 略してPET)と言う。
【2-デオキシ-D-グルコースは抗がん剤治療や放射線治療の効き目を高める】
2-デオキシ-D-グルコース(2-DG)はがん細胞の解糖系を阻害するので、がん細胞の増殖速度を低下させる効果がありますが、2-DG単独ではがん細胞を死滅させる作用は弱いと言わざるをえません。
今まで、動物実験や人間での研究が報告されていますが、2-DGの投与だけでは十分な抗腫瘍効果は得られていません。がん細胞のグルコースを完全に枯渇させることが現実的に困難だからです。
しかし、がん細胞のエネルギー産生や物質合成の経路を阻害すると、抗がん剤や放射線に対するがん細胞の感受性が高まります。つまり、抗がん剤治療や放射線治療の時に2-DGを服用すると、それらの抗腫瘍効果を高めることができます。以下のような報告があります。
A phase I dose-escalation trial of 2-deoxy-D-glucose alone or combined with docetaxel in patients with advanced solid tumors.(進行した固形がんの患者における2-デオキシ-D-グルコースの単独およびドセタキセル併用の第1相用量増加試験) Cancer Chemother Pharmacol. 71(2):523-30, 2013年 【論文内容の要約】
この第1相試験は、進行した固形がんの患者34人を対象にして、解糖系阻害剤の2-デオキシ-D-グルコース(2-DG)の単独およびドセタキセルを併用した場合の、安全性と薬物動態と最大耐用量(患者が耐えられる最大投与量)を評価する目的で実施された。 最大耐用量の基準に相当する用量制限性毒性は認めなかった。 最も多い副作用は倦怠感、発汗、めまい、吐き気であり、2-DG投与で予想される低血糖の症状と類似していた。 63mg/kgを臨床的耐用量と決定した。63-88 mg/kgの投与でみられた最も重要な副作用は高血糖(100%)、消化管出血(6%)、可逆性のグレード3の心電図上のQTc延長(22%)であった。 12例(32%)は病状安定(stable disease)、1例(3%)は部分奏功、22例(66%)は病状進行であった。2DGとドセタキセルの薬物動態において相互作用は認めなかった。 結論:週1回のドセタキセル投与との併用療法における2GDの推奨投与量は63mg/kg/day であった。2-DGを抗がん剤治療と併用する場合の2-DG投与量の一つの目安として、1日に体重1kg当たり63mgという報告です。2-DGはグルコースと競合的に取込まれるため、糖質の摂取が少ない条件では、2-DGの服用量を減らしても抗腫瘍効果が期待できます。つまり、糖質制限食やケトン食を行えば、2-DGの摂取量をかなり減らせます。
2-DGとの併用で効果増強が報告されている抗がん剤として、上記のドセタキセル以外に、ドキソルビシン、5-フルオロウラシル、トラスツズマブ(Trastuzumab;商品名はハーセプチン)、シクロフォスファミドなどもあります。いずれも、それぞれの抗がん剤単独の場合より、2-DGを併用すると抗腫瘍効果が増強することが報告されています。
また、放射線治療との併用においても、2-DGが放射線治療の効果を増強することが報告されています。
【2-デオキシ-D-グルコースとメトホルミンの相乗効果】
2-デオキシ-D-グルコースは解糖系を阻害することによってATP産生を阻害します。経口糖尿病薬のメトホルミンはミトコンドリアの呼吸酵素を阻害してATPの産生を阻害する作用が知られています。
がん細胞のエネルギー産生経路を2-デオキシ-D-グルコースとメトホルミンで二重阻害すると抗腫瘍効果が増強することがマウスを使った移植腫瘍の実験で示されています。以下のような報告があります。
Dual inhibition of Tumor Energy Pathway by 2-deoxy glucose and metformin Is Effective Against a Broad Spectrum of Preclinical Cancer Models(2-デオキシグルコースとメトホルミンによる腫瘍細胞のエネルギー産生経路の2重の阻害は、多くの前臨床の動物実験モデルにおいて効果がある) Mol Cancer Ther. 10(12): 2350-2362, 2011年
この研究はテキサス大学のMDアンダーソンがんセンターの研究グループからの報告です。
様々な種類のがん細胞をマウスに移植した実験モデルを用いて、2-デオキシグルコース(2-DG)とメトホルミンを同時に投与すると、抗腫瘍効果が相乗的に高まることを報告しています。
2-DGとメトホルミンはそれぞれ単独では抗腫瘍効果は強くはありませんが、併用すると強い抗腫瘍効果が得られるという結果です。
培養がん細胞を用いた実験では、2-DGで解糖系を阻害しても、がん細胞を死滅させるだけの効果はありませんが、メトホルミンを同時に投与すると、がん細胞は死滅しました。
マウスの移植腫瘍の実験系でも、2-DGとメトホルミンを同時に投与すると、がん組織が著明に縮小しました。
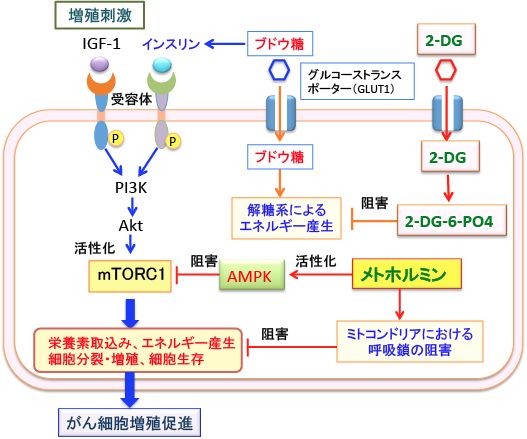
がん細胞が増殖するためには、増殖のシグナルと、エネルギー産生と物質合成のための材料が必要です。
増殖シグナル伝達系は、インスリン/インスリン様成長因子-1(IGF-1)とそれらの受容体の結合によって刺激されるPI3K/Akt/mTORC1伝達系 が重要です。
メトホルミンはミトコンドリアの呼吸鎖(電子伝達系)を阻害してATP産生を阻害する作用がありますが、さらにAMP活性化プロテインキナーゼ(AMPK)を活性化してmTORC1(哺乳類ラパマイシン標的蛋白質複合体-1)の活性を阻害することによってがん細胞の増殖を阻害します。
一方、2-DGはグルコースの解糖系とペントース・リン酸経路での代謝を阻害することによって、エネルギー産生と物質合成を抑制し、その結果、がん細胞の増殖が抑えられます。
すなわち、2-DGとメトホルミンの同時投与は、がん細胞のエネルギー産生と物質合成と増殖シグナル伝達を効率的に阻害することによって、がん細胞の増殖を阻害することができるのです。
図:2-デオキシ-D-グルコース(2-DG)が細胞内でリン酸化されてできる2-DG-6-リン酸は解糖系を阻害してエネルギー産生を低下させる。メトホルミンはAMP活性化プロテインキナーゼ(AMPK)を活性化し、AMPKは哺乳類ラパマイシン標的蛋白質複合体1(mTORC1)の活性を阻害して、がん細胞の増殖を抑制する。さらに、ミトコンドリアにおける呼吸鎖(電子伝達系)を阻害してATPの産生を低下させ、がん細胞の増殖を抑制する。
【メトホルミンはAMPKを活性化してがん細胞の増殖を抑制する】
メトホルミン(metformin)は2型糖尿病の治療薬(ビグアナイド系経口血糖降下剤)ですが、がんの予防や治療の分野でも注目されており、がん予防効果やがん細胞の抗がん剤感受性を高める効果などが数多くの論文で報告されています。
メトホルミンは、AMP活性化プロテインキナーゼ(AMPK)を介した細胞内信号伝達系を刺激することによって糖代謝を改善します。すなわち、筋・脂肪組織においてインスリン受容体の数を増加し、インスリン結合を増加させ、インスリン作用を増強してグルコース取り込みを促進します。さらに肝臓に作用して糖新生を抑え、腸管でのブドウ糖吸収を抑制する作用があります。これらの作用はインスリンの血中濃度を低下させます。インスリンはがん細胞の増殖を促進するので、インスリンの血中濃度を減らすだけで、がん細胞の増殖を抑制する効果があります。
さらに、AMPKはインスリンおよびインスリン様成長因子-1(IGF-1)によって活性化されるPI3K/Akt/mTORC1シグナル伝達系のmTORC1(哺乳類ラパマイシン標的タンパク質複合体1: mammalian target of rapamycin complex 1)の活性を阻害します。
また、HMG-CoA還元酵素とアセチルCoAカルボキシラーゼを阻害することによって脂質合成を阻害します。
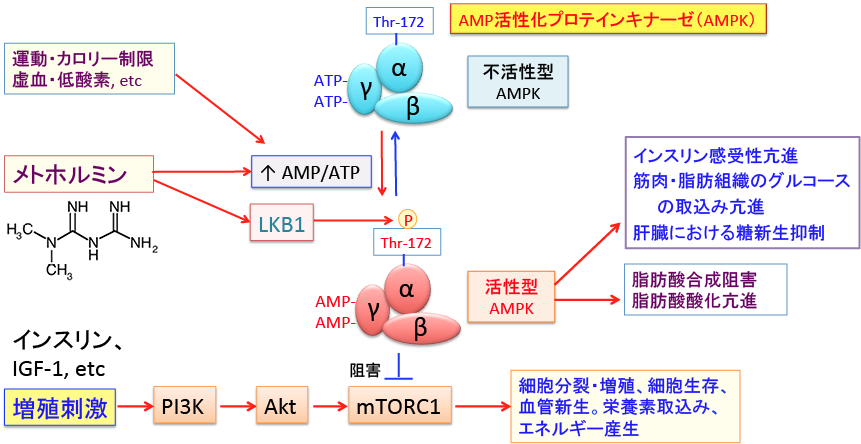
図:AMP活性化プロテインキナーゼ(AMPK)は細胞のエネルギー代謝を調節する因子として重要な役割を担っている。 AMPKは低グルコースや低酸素や虚血など細胞のATP供給が枯渇させるようなストレスに応答して活性化される。 AMPKは触媒作用を持つαサブユニットと、調節作用を持つβサブユットとγサブユニットから構成されるヘテロ三量体として存在する。
γサブユニットにはATPが結合しているが、ATPが枯渇してAMP/ATP比が上昇すると、γサブユニットに結合していたATPがAMPに置き換わる。その結果、アロステリック効果(酵素の立体構造が変化すること)によってこの複合体は中等度(2〜10倍程度)に活性化され、上流に位置する主要なAMPKキナーゼであるLKB1に対して親和性が高くなり、LKB1によってαサブユニットのスレオニン-172(Thr-172)がリン酸化されると、酵素活性は最大に活性化される。 LKB1はセリン・スレオニンキナーゼで、AMP活性化プロテインキナーゼ(AMPK)をリン酸化して活性化する。
リン酸化されたAMPKはmTORC1(哺乳類ラパマイシン標的タンパク質複合体1)を抑制し、タンパク質や脂肪酸の合成を抑制して、がん細胞の増殖を抑制する。
【グルコース枯渇によって誘導される小胞体ストレス応答を阻害する牛蒡子のアルクチゲニン】
がん細胞はグルコース枯渇などの栄養飢餓の状態になると、細胞死を起こさないようにするメカニズムが活性化します。そのようなメカニズムの一つとして「小胞体ストレス応答」があります。小胞体ストレス応答が活性化すると、がん細胞は栄養飢餓の状態でも生き残ることができます。このような栄養飢餓に対する抵抗性を阻害する物質として牛蒡子に含まれるアルクチゲニンが知られています。アルクチゲニンが2-デオキシ-D-グルコースとの併用で抗腫瘍効果を高めるという報告もあります。以下のような報告があります。
① アルクチゲニンはがん細胞の栄養飢餓に対する耐性を抑制する。
Identification of arctigenin as an antitumor agent having the ability to eliminate the tolerance of cancer cells to nutrient starvation.(がん細胞の栄養飢餓に対する耐性を取り除く能力を持つ抗がん成分としてのアルクチゲニンの同定)Cancer Res. 66(3):1751-1757. 2006
がん細胞は急速に増殖するため、酸素や栄養素の需要は高くなるのですが、血液の供給が追いつかない場合は、がん細胞は酸素や栄養素が不足しがちになります。しかし、がん細胞にこのような栄養飢餓の状態に対して、エネルギー代謝を変え、栄養や酸素が不足した状態でも死なないで増殖を続けようとします。このような栄養飢餓に対する耐性のメカニズムを阻害してやれば、がん細胞は死にやすくなり、抗がん剤の効き目を高めることができます。この論文では、アルクチゲニンは、がん細胞がグルコース不足の状態に耐えるために活性化されるAktという酵素の活性を阻害するメカニズムによって、栄養飢餓に対する耐性の獲得を阻止する可能性が示唆されています。
② アルクチゲニンは小胞体ストレス応答を阻害することによって、グルコースの枯渇によるがん細胞死を促進する。
Arctigenin blocks the unfolded protein response and shows therapeutic antitumor activity.(アルクチゲニンは小胞体ストレス応答を阻害し、抗腫瘍活性を示す)J Cell Physiol. 224(1): 33-40, 2010
Arctigenin suppresses unfolded protein response and sensitizes glucose deprivation-mediated cytotoxicity of cancer cells.(アルクチゲニンは小胞体ストレス応答を抑制しグルコース枯渇によるがん細胞死の感受性を高める)Planta Med. 77(2):141-5. 2011
がん細胞はグルコース要求が高いので、グルコース飢餓への適応は腫瘍内での細胞生存に大変重要な役割を担っています。グルコース飢餓に対する適応応答を阻害することががん治療に役立つと考えられています。
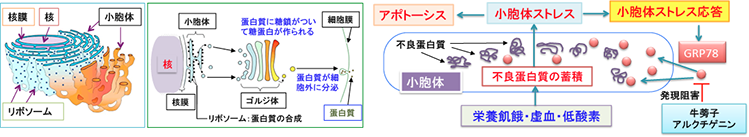
細胞内のリボソームで作られた蛋白質は、小胞体で修飾を受けて高次構造(折り畳み)を形成し、さらにゴルジ体で糖鎖の結合などによって成熟蛋白質となって細胞外へ搬出、あるいは細胞内で利用されます。低酸素やグルコース枯渇や栄養飢餓状態が起こると、折り畳みに異常をきたした不良蛋白質が小胞体に蓄積し、これを『小胞体ストレス』といいます。小胞体ストレスに対して細胞はGRP78などのシャペロン蛋白の発現が亢進して小胞体ストレスを回避し、アポトーシス(細胞死)が起こらないようにしています。これを小胞体ストレス応答 (unfold protein response: UPR)と言います。
この小胞体ストレス応答を阻害するとがん細胞はグルコース枯渇や栄養飢餓や低酸素によって死にやすくなります。アルクチゲニンはGRP78の発現を阻害して小胞体ストレス応答を阻害する作用が報告されています。
③ アルクチゲニンはグルコースを枯渇させたがん細胞の細胞死を促進する。
Arctigenin preferentially induces tumor cell death under glucose deprivation by inhibiting cellular energy metabolism.(アルクチゲニンは細胞のエネルギー代謝を阻害することによってグルコース枯渇下においてがん細胞に選択的に細胞死を誘導する)Biochem Pharmacol. 84(4):468-76.2012.
この論文では、グルコース類似体の2-デオキシグルコースとアルクチゲニンを同時に投与すると、がん細胞に特異的に細胞死を誘導することが報告されています。2-デオキシグルコースはグルコースと類似の構造で、グルコースと同じように細胞に取り込まれますが、解糖系で代謝されず、解糖系の酵素を阻害する作用があります。つまり、グルコースを枯渇させ、がん細胞のグルコース取り込みを阻害しているのと同じような作用です。このような状況でアルクチゲニンを併用すると、がん細胞が特異的に死滅するという報告です。
④ アルクチゲニンはAMPK(AMP活性化プロテインキナーゼ)を活性化する。
Arctigenin, a natural compound, activates AMP-activated protein kinase via inhibition of mitochondria complex I and ameliorates metabolic disorders in ob/ob mice.(天然成分のアルクチゲニンはミトコンドリアの呼吸酵素複合体を阻害することによってAMP活性化プロテインキナーゼを活性化し、ob/obマウスにおける代謝異常を軽減する) Diabetologia. 55(5):1469-81.2012
グルコース代謝のセンサーはグルコースそのものを検知するのではなく、代謝によって産生されたATPを介してグルコース量をモニターしています。その代表的な因子がAMP活性化プロテインキナーゼ(AMP-activated protein kinase:AMPK)です。AMPKはAMP(Adenosine Monophosphate:アデノシン-1-リン酸)で活性化されるタンパクリン酸化酵素で、低グルコース、低酸素、虚血、熱ショックのような細胞内 ATP供給が枯渇する状況において、AMPの増加に反応して活性化され、異化の亢進(ATP産生の促進)と同化の抑制(ATP消費の抑制)を誘導し、ATPのレベルを回復させる効果があります。すなわち、AMPKが活性化すると、糖や脂肪や蛋白質の合成は抑制され、一方、糖や脂肪や蛋白質の分解(異化)が亢進してATPが産生されます。
アルクチゲニンはミトコンドリアの呼吸酵素複合体Iの働きを阻害することによってATPを低下させ、その結果、AMPKが活性化されます。
解糖やTCA回路によりNADH2+やFADH2の形で捕捉された水素は,ミトコンドリアのクリステにおいて,順次エネルギーが低くなるような一連の酵素系(複合体 I〜IV)の連鎖を経て,最終受容体である酸素(O2)に渡されて水 H2Oになります。 複合体 I〜IVの段階は,ミトコンドリア内膜のタンパク質や補酵素間で電子のやり取りが起こる過程であるため電子伝達系と呼ばれます。アルクチゲニンはこの複合体-Iの働きを阻害する作用があると言うことです。 AMPKを活性化するメトホルミンとベルベリンもこの電子伝達系の複合体-Iを阻害することによってATPを低下させ、AMPKを活性化することが報告されています。
メトホルミンがグルコース飢餓環境下で小胞体ストレス応答を抑制するという報告もあります。つまり、アルクチゲニンとメトホルミンは同様のメカニズムによる抗腫瘍効果があるようです。
【小胞体ストレス応答とは】
細胞内のリボソームで合成された蛋白質は小胞体で修飾を受け、高次構造(折り畳み)を形成しながら成熟蛋白質となって細胞外へ搬出される。正常な折り畳みがなされた蛋白質はゴルジ体へ送られるが、折り畳みに失敗した異常な蛋白質は小胞体にとどまる。このような正常な高次構造に折り畳まれなかった異常蛋白質が小胞体内に蓄積して、細胞への悪影響(=ストレス)が生じることを小胞体ストレス(ERストレス:Endoplasmic reticulum stress)と言う。
小胞体ストレスは細胞の機能を妨げるため、細胞にはその障害を回避する仕組みが備わっている。この小胞体ストレスに対する細胞反応を小胞体ストレス応答 (unfold protein response: UPR) と言う。 小胞体ストレスの原因となる変性蛋白質は、遺伝子変異、ウイルス感染、炎症、有害化学物質、栄養飢餓、低酸素(虚血)などにより生じる。
変性蛋白質は小胞体ストレスセンサー(IRE1alpha, ATF6, Perk など)によって感知され、小胞体ストレス応答を誘導する。小胞体ストレス応答は、蛋白質の産生量を低下させることで小胞体における蛋白質の折りたたみを軽減したり、分子シャペロンの量を増やすことで折りたたみ機能を向上させたり、変性蛋白質の除去効率をあげることで小胞体ストレスを取り除くように働く。
変性蛋白質が過剰に蓄積し、小胞体ストレスの強さが細胞の回避機能を越えると、細胞死(アポトーシス)が誘導される。小胞体ストレスはアルツハイマー病などの神経変性疾患などさまざまな疾患の原因となると考えられている。
分子シャペロン (Molecular chaperone) とは、他の蛋白質分子が正しい折りたたみ(3次元構造)をして機能を獲得するのを助ける蛋白質の総称で、 分子シャペロンには多くの種類があるが、小胞体ストレスが負荷されたときに特異的に発現が誘導される分子シャペロンの一つがGRP78。GRP78とは78-kDa glucose-regulated proteinのことで、分子量が78000のグルコース制御性蛋白質という意味の蛋白質で、その発現量は小胞体ストレス応答 (unfold protein response: UPR)の指標となる。
固形がんは生体内において低酸素・低栄養という環境に適応するための様々なストレスに対する耐性を獲得している。その中でも小胞体 (ER) 内で分子シャペロンとして働くGRP78の発現亢進は、ストレス耐性において最も大きな役割を担っていることが明らかになっている。 すなわち、本来であれば、低酸素・低栄養の環境で、小胞体ストレスの増大によってがん細胞は死滅するが、がん細胞内ではGRP78の発現が亢進してERストレス応答が増強しているために死ななくなっていると考えられている。つまり、GRP78はグルコース欠乏など細胞にストレスがかかった際に細胞死を避けるために誘導されるたんぱく質と言え、 したがって、GRP78の発現誘導などの小胞体ストレス応答を特異的に阻害する物質は、抗がん剤治療が困難な固形癌に対して抗がん作用を発揮することが期待されている。また、抗がん剤の効き目(感受性)を高めることも報告されている。
【2-デオキシ-D-グルコースの毒性について】
解糖系を阻害すれば、正常細胞のエネルギー産生にも影響するので、高用量や長期間の2-DGの摂取は毒性が出る可能性はあります。しかし、以前は2-DGが抗老化の目的で研究されたこともあります。
カロリー制限による寿命延長の研究を行ってる米国国立老化研究所(National Institute on Aging)のジョージ・ロス(George Roth)博士の研究グループは、カロリー制限と同じ効果を真似る薬の開発において、2-DGの可能性を研究していました。
普通に食事を摂取しても2-DGによってグルコースの代謝を抑制すれば、たくさん食べても太らずにすむし、カロリー制限と同じメカニズムで老化予防に有効ではないかという仮説です。
しかし、ラットの実験では2-DGを大量に長期間投与すると心筋細胞の空砲化と死亡率の上昇などの毒性が確認されています。(Toxicol Appl Pharmacol 243(3): 332-9, 2010年)
つまり、老化予防や寿命延長の目的では2−DGは有用とは言えないようです。
ただし、てんかんやがんの治療目的においては、臨床効果の方が毒性より上回っていると考えられ、人間での臨床試験が行われています。
ジョージ・ロス博士らの研究グループの現在のターゲットは、インスリン受容体の感受性を高める薬(insulin receptor sensitizers)、サーチュイン活性化剤(sirtuin activators)、mTORの阻害剤(inhibitors of mTOR)のようです。この3つを全て達成できるのがケトン食なのですが、ロス博士らはケトン食による寿命延長の可能性についてはまだ何も言及していないようです。(メトホルミンもこの3つの機序による抗老化と抗がん作用が指摘されています。)2DGの毒性に関しては、マウスの実験では50%致死量は2g/kg以上という報告があります。(Cent Eur J Biol. 5:739–748. 2010年)
人での検討では200mg/kgくらいまでは投与できるという報告もあります。前述の第1相試験の結果では、抗がん剤との併用において1日体重1kg当たり60mg程度の投与量が推奨されています。
まだ、長期投与の安全性は十分に検討されていないため、がんの再発予防の目的ではまだ推奨できませんが、進行がんの治療の目的で抗がん剤などとの併用など短期間の使用に関しては問題無いようです。
2DGとグルコースが競合してがん細胞のエネルギー代謝を阻害するため、糖質制限でグルコースの摂取量を減らせば、2DGは少ない量で阻害作用を発揮できます。
ケトン食に2DGを併用すると、がん細胞のグルコース枯渇状態を増強できます。
2-デオキシ-D-グルコースは比較的高価ですが、当院(銀座東京クリニック)では1g当たり500円で販売しています。体重60kgの場合、60mg/kg/日の投与量だと1ヶ月に5万円程度の費用になりますが、糖質制限やケトン食との併用であれば、その半分から3分の1程度に減らしても十分に効果は期待できるため、1ヶ月分が2万円程度ですみます。進行がんの治療や抗がん剤や放射線治療との併用で試してみる価値はあります。
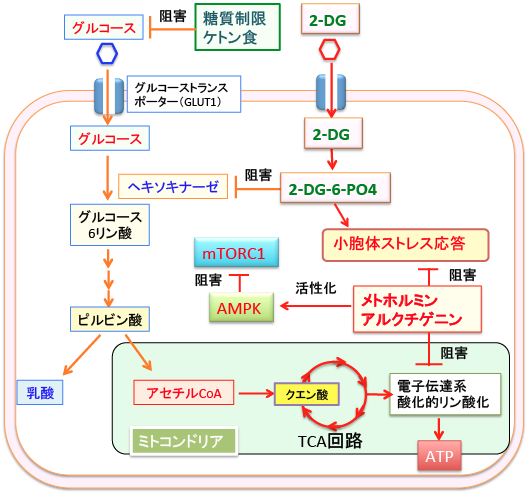
このとき、メトホルミン(商品名メトグルコ)や牛蒡子が多く入った煎じ薬を併用すると、がん細胞を死滅させる効果を高めることができます。(下図)
図:糖質制限食やケトン食は、がん細胞における2-デオキシ-D-グルコース(2-DG)の細胞内取込みを高め、解糖系を阻害して、エネルギー(ATP)の産生や、細胞分裂に必要な物質の合成を阻害する。経口糖尿病薬のメトホルミンと牛蒡子に含まれるアルクチゲニンは、ミトコンドリアにおける呼吸鎖(電子伝達系)を阻害してATPの産生を低下させ、小胞体ストレス応答を阻害し、AMP活性化プロテインキナーゼ(AMPK)を活性化することによって、がん細胞の増殖を抑制する。
| *2-デオキシ-D-グルコースを50g/30,000円で販売しています。 抗がん剤や放射線治療との併用では50〜60mg/kg/日を目安に服用します。 糖質制限やケトン食を実施している場合は、20〜30 mg/kg/日で効果が期待できます。 |