還元型グルタチオンを枯渇してがん幹細胞を死滅させるケトン食と2-DGとスルファサラジン
【がん細胞に対するグルタチオンの2面性】
理想的ながん治療の条件は、①がん細胞に特異的であること、②がん細胞を悪化させないこと、だと言えます。
正常細胞にはダメージを与えずにがん細胞だけを攻撃する「がん細胞に特異性(選択性)の高い治療法」であれば、副作用がなくがんを縮小・消滅できます。しかし、実際問題として、そのような理想的ながん治療はまだ存在しません。分子標的薬のようにがん細胞に選択性が高いものもありますが、そのような分子標的薬でも、細胞の増殖や死の制御システムをターゲットにする限り正常細胞にも何らかの影響を及ぼすので、効果がある薬は副作用が伴います。正常な組織も増殖や再生を行っているからです。
がん細胞の発生を予防したり増殖を抑える方法が、時と場合によって逆効果になる(がんを悪化させたり増殖を促進する)場合があります。このような作用や効果を現す用語として「2面性」とか「諸刃の剣」などが使われます。
例えば、がん細胞を壊死させる作用がある腫瘍壊死因子-α(Tumor Necrosis Factor-α, TNF-α)は、マクロファージによって産生され、固形がんに対して出血性の壊死を生じさせるサイトカインとして発見されたため、マクロファージを活性化する物質の抗腫瘍効果のメカニズム研究では、TNF-αの産生増加が抗がん作用との関連で言及されます。
しかし、TNF-αは炎症を増悪し、がん細胞に酸化ストレスを高めて悪性化を促進するので、むしろがんを悪化させる作用が問題となっており、がんの予防や治療の分野では、TNF-αの産生を抑制することが治療のターゲットになっています。(ただし、後述するように、がん細胞に酸化ストレスを徹底的に高めることによってがん細胞の死滅を目標にする場合もあり、どちらが良いかはケースバイケースと言える。)
抗酸化物質も同様の2面性を持っています。活性酸素やフリーラジカルによるDNAのダメージが遺伝子変異を起こしてがん発生の引き金になるので、活性酸素やフリーラジカルを消去する抗酸化物質はがん細胞の発生を予防する効果を発揮します。
野菜や果物ががんの予防に役立つのは、それらの食品にはフラボノイドやカテキンなど抗酸化作用の強い成分を多く含むからだと考えられています。
したがって、抗酸化作用の強い食品成分を材料にしたサプリメントががん予防の目的で利用されています。
しかし一方、放射線治療や抗がん剤治療では、活性酸素やフリーラジカルの発生ががん細胞を死滅させるメカニズムになっています。したがって、放射線治療や抗がん剤治療を行っているときに抗酸化物質を多く摂取することは、抗がん作用を弱める可能性が指摘されています。抗酸化作用のある物質は、がん細胞を酸化ストレスから保護することになるのです。
したがって、放射線治療や抗がん剤治療を行っているときは、がん細胞の酸化ストレスを高める方法が有用だと考えられています。
この「がん細胞の酸化ストレスを高める方法」のターゲットの一つがグルタチオンです。
グルタチオンは細胞内に高濃度に存在する抗酸化物質で、活性酸素やフリーラジカルから細胞を守る役割を担っています。したがって、発がん予防の観点からは、グルタチオンの合成を増やして濃度を高めることは、抗酸化力を高め、遺伝子のダメージや変異を防ぐ効果が期待できます。
一方、抗がん剤や放射線治療を行っているときは、グルタチオンの濃度が高いと、がん細胞が死ににくくなります。
がん細胞の抗がん剤耐性や放射線耐性の原因の一つとして、がん細胞ではグルタチオンの産生が増えているためという報告があります。つまり、がん細胞は抗がん剤や放射線治療を受けると、それらによる細胞傷害に抵抗する手段としてグルタチオンの合成を増やしているのです。したがって、がん細胞のグルタチオンの産生を妨げると、抗がん剤や放射線治療の効果が高まることになります。
【還元型グルタチオンと酸化型グルタチオン】
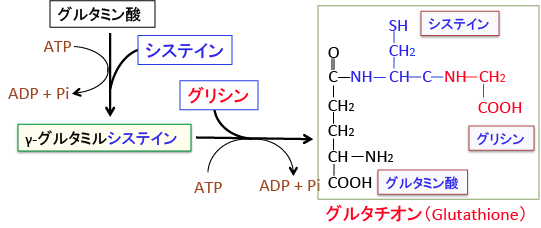
グルタチオン(Glutathione)というのは、グルタミン酸とシステインとグリシンの3つのアミノ酸が結合したトリペプチドです。
γ-グルタミルシステイン合成酵素によってグルタミン酸とシステインが結合してγ-グルタミルシステインを合成します。引き続いてグルタチオン合成酵素によってγ-グルタミルシステインにグリシンが結合してグルタチオンが合成されます。この合成にはATPが必要です。
つまり、グルタミン酸やシステインやグリシンが不足したり、ATPが十分に産生できなかったり、γ-グルタミルシステイン合成酵素やグルタチオン合成酵素の活性が阻害されれば、グルタチオンの濃度は低下して、酸化ストレスに対する抵抗力が低下することになります。
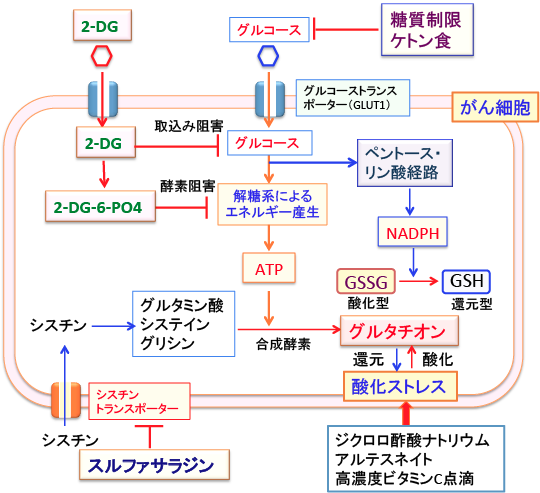
ケトン食でがん細胞のグルコース代謝を低下させればATP産生が低下します。シスチン・トランスポーターの阻害作用のあるスルファサラジンが細胞内のシステインを減らしてグルタチオンの濃度を低下させ、その結果、がん細胞の酸化ストレス抵抗性を減弱することが報告されています。(シスチンはシステイン2分子がS-S結合したアミノ酸で、細胞内でシステインになります)
図:グルタチオンは3つのアミノ酸(グルタミン酸、システイン、グリシン)が結合して合成される。
グルタチオンは細胞内に0.5~10mMという非常に高濃度で存在します。チオール基(SH基)を持ち、この水素が電子を供与することによって活性酸素やフリーラジカルを消去します。
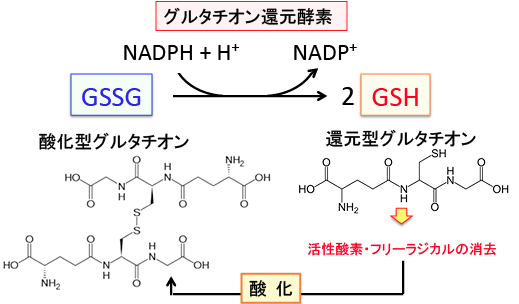
還元型グルタチオンはGSH(Glutathione-SH)と表記され、GSHが活性酸素などで酸化されると酸化型グルタチオンGSSG(Glutathione-S-S-Glutathione)になります。
つまり、酸化型は、二分子の還元型グルタチオンがジスルフィド結合(2個のイオウ原子が繋がった状態)によってつながった分子です。
細胞内で発生した活性酸素やフリーラジカルに電子を与えて酸化型になったグルタチオンを還元型に戻す酵素がグルタチオンレダクターゼ(グルタチオン還元酵素)で、このときNADPH(ニコチンアミドアデニンジヌクレオチドリン酸、nicotinamide adenine dinucleotide phosphate)から水素をもらいます。
図:還元型グルタチオンは活性酸素(スーパーオキサイド、過酸化水素など)などと反応して酸化され、2量体化した酸化型グルタチオン(GSSG)に変化するが、グルタチオン還元酵素がNADPHからの電子をGSSGに転移して、GSH(還元型グルタチオン)に再生される。
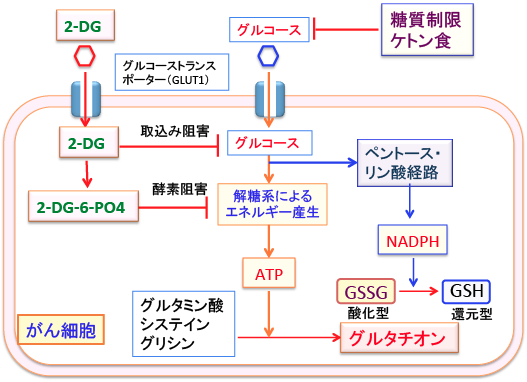
NADPHはグルコース代謝のペントース・リン酸経路で産生されます。つまり、がん細胞のグルコース取り込みや解糖系やペントース・リン酸経路を阻害するケトン食や2−デオキシ-D-グルコースはNHDPHの供給を減らすことによって、グルタチオンの合成を低下させ、酸化ストレスに対する抵抗性を減弱させることができます。(ATP産生低下はグルタチオン合成を低下させます)
図:2-デオキシ-D-グルコース(2-GD)と糖質制限やケトン食はがん細胞のグルコース取込みや代謝を阻害してATPとNADPHの産生を阻害する。ATPとNADPHの量が減ると、グルタチオンの合成や酸化型から還元型への変換ができなくなって、がん細胞は酸化ストレスに対して抵抗性が無くなる。
【スルファサラジンはがん幹細胞のグルタチオン濃度を低下させて死にやすくする】
がん幹細胞が抗がん剤などで死ににくい理由の一つとして、グルタチオンの関与が指摘されています。
慶應義塾大学先端医科学研究所遺伝子制御研究部門の佐谷秀行教授らの研究グループは、がん幹細胞表面マーカーの接着分子CD44の作用について研究しています。CD44はヒアルロン酸をリガンドとする接着因子で、乳がんや大腸がんなど多くの固形がんにおけるがん幹細胞のマーカーとして知られています。
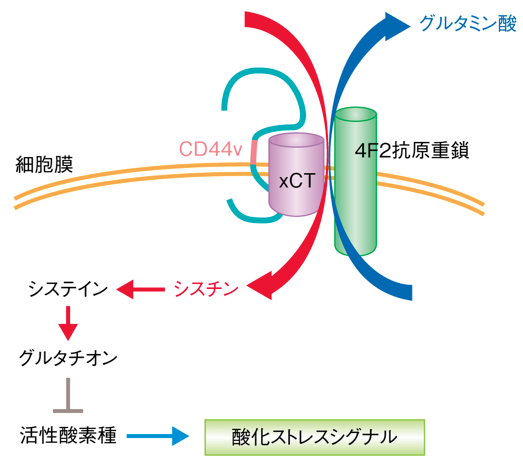
CD44のバリアントアイソフォーム(CD44v)が陽性のがん細胞は腫瘍形成能力が高く、転移をしやすいことが知られていますが、このCD44vが細胞内にシスチンというアミノ酸を取り込むシスチン・トランスポーターの働きを高める結果、還元型グルタチオン(GSH)の合成を促進することで、がん細胞における酸化ストレス抵抗性を高め、増殖や転移や治療抵抗性を高めていることを明らかにしています。
シスチン・トランスポーター(xCT)は、哺乳類細胞形質膜上に発現するアミノ酸トランスポーターの一種であり、細胞内のグルタミン酸との交換により細胞外のシスチンを細胞内に輸送する機能を有します。シスチンはグルタチオンの構成成分であるシステインが2個結合したアミノ酸で、シスチンが細胞内に取り込まれると、システインに代わってグルタチオンを合成する材料になるというわけです。
このトランスポーターが誘導されることにより、細胞内グルタチオンレベルが上昇し、これによって、活性酸素などの酸化ストレスに対する防御能が高まると考えられます。
佐谷教授らのグループは「CD44vがシスチントランスポーターを細胞表面に安定化することで、シスチンの取込みを亢進し、グルタチオンの合成量を高め、酸化ストレスに強くなるから、増殖や転移や抗がん剤抵抗性が亢進する」と報告しています。
そして、スルファサラジン(別名:サラゾスルファピリジン:商品名はサラゾピリンなど)という潰瘍性大腸炎の治療に使われている既存薬にシスチン・トランスポーターを特異的に阻害する作用があることが報告されています。そこで、抗がん剤にこのスルファサラジンを併用する臨床試験が行われています。(これらの内容については、慶応大学のプレスリリースやニュース記事や論文の日本語訳などがネット上に多数出ています。「CD44」「シスチントランスポーター」「スルファサラジン」「がん幹細胞」などのキーワードを複数組み合わせて検索すれば多数でてきます。)
図:がん幹細胞のマーカーであるCD44のバリアントアイソフォーム(CD44v)は細胞膜の表面においてシスチントランスポーター(xCT)を安定化させることで細胞外からのシスチンの取込みを増加させ、グルタチオンの生成を促進することで酸化ストレスを軽減できる。
(図と文の出典:新着論文レビュー『CD44のバリアントアイソフォームはシスチントランスポーターxCTを細胞表面に安定化することでがん細胞の活性酸素種を制御し腫瘍の形成を促進する』永野 修・佐谷秀行(慶應義塾大学医学部 先端医科学研究所遺伝子制御研究部門)
http://first.lifesciencedb.jp/archives/2409シスチントランスポーターの阻害剤であるスルファサラジンを投与すれば、がん細胞内のグルタチオンの濃度が低下し、酸化ストレスに対する抵抗性が低下するので、抗がん剤や放射線治療が効きやすくなると推測されます。そこでそのような臨床試験が始まっているということです。
シスチントランスポーターの阻害以外にも、グルタチオン合成に関与する酵素の阻害剤なども臨床試験が行われています。
グルタチオンの生合成や酸化型から還元型のグルタチオンに再生するメカニズムの複数の作用点を同時に阻害すれば、より効率的にグルタチオンの濃度を低下させることができます。
そのような方法としてがん細胞のグルコース代謝を阻害するケトン食や2-デオキシ-D-グルコースの有効性も指摘されています。
図:グルタチオンは細胞内の酸化ストレスの軽減に重要な役割を果たしている。がん細胞内の還元型グルタチオンの量が多いと、抗がん剤や放射線治療に抵抗性になる。スルファサラジンはシスチン・トランスポーターを阻害することによってグルタチオンの合成を阻害する。2-デオキシ-D-グルコース(2-DG)やケトン食は解糖系によるATP産生やペントース・リン酸経路でのNADPH産生を低下させることによって還元型グルタチオンの量を減らす。さらに、がん細胞内の酸化ストレスを高めるジクロロ酢酸ナトリウム、アルテスネイト、高濃度ビタミンC点滴などを併用するとグルタチオンが枯渇して、がん細胞を死滅させることができる
【がん細胞に酸化ストレスを高める治療とケトン食の併用効果について】
悪性度の高い転移性のがんを移植するマウスの実験モデルで、ケトン食と高圧酸素療法の組み合わせによる治療が生存期間を延ばすことが、南フロリダ大学の高圧生体医学研究所(Hyperbaric Biomedical Research Laboratory at the University of South Florida)の研究チームの研究で明らかになっています。
その研究結果を以下に紹介します。
【要旨】
研究の背景:がん細胞のエネルギー代謝は解糖系への依存が高いので、がん細胞のグルコースの利用を阻害することはがんの治療に役立つ。
ケトン食は低糖質と高脂肪の食事で、血中のグルコースを減らしケトン体を増やすことによってがん細胞の増殖速度を遅くすることが、動物や人間での研究で示されている。
がん組織では血管網の発達が悪いために一部が低酸素状態になり、そのためにがん細胞の増殖や解糖への依存度を高める。
高圧酸素療法(Hyperbaric Oxygen Therapy)はがん組織に酸素を与えることによって、低酸素によるがん細胞増殖促進作用を阻止することができる。
この2つの毒性のない治療法は、ともにがん細胞の代謝の異常をターゲットにしているという観点から、この2つの治療法を併用した場合の抗腫瘍効果をがんの転移の実験モデルを用いて検討した。
方法:ホタル・ルシフェラーゼで標識して発光するように改変した転移性のがん細胞を用い、生体イメージング法によってマウスを生きた状態でがんの成長を観察できる実験モデルを用いた。普通食あるいはケトン食で飼育し、高圧酸素療法(2.5気圧、90分、週に3回)を併用した場合の効果を検討した。
結果:ケトン食単独で、血糖は低下し、がんの成長は低下し、全身転移したマウスの平均生存期間は普通食に比べて56.7%の延長を認めた。
高圧酸素療法のみではがん組織の成長に影響は認めなかったが、ケトン食と高圧酸素法を組み合わせると、血糖の著明な低下を認め、がんの成長は抑制され、平均生存期間はコントロールに比べて77.9%の延長を認めた。
結論:全身転移するマウスのがんの実験モデルにおいて、ケトン食と高圧酸素療法を併用するとケトン食単独よりも抗腫瘍効果は増強された。この実験結果から、ケトン食と高圧酸素療法の併用療法は、全身転移したがんに対する副作用のないがん治療法、あるいは標準治療の補助療法として有用である可能性が示唆され、さらなる研究が必要である。高圧酸素療法ががん細胞を死滅させるメカニズムとして、低酸素で誘導される低酸素誘導因子-1(HIF-1)の活性を低下させる(HIF-1はがん細胞の増殖を促進する)ことや、がん細胞に酸化ストレスを高めるからです。
がん細胞は酸化ストレスに弱いので、酸素を無理矢理与えて酸化ストレスを与えると細胞はダメージを受けます。
このとき、グルコースが十分にあれば、解糖系で産生されるエネルギーとペントース・リン酸経路で生成されるNADPHによって酸化傷害に対して抵抗性と回復力を高めることができますNADPH(ニコチンアミドアデニンジヌクレオチドリン酸) は、細胞内の過酸化水素や過酸化脂質の消去に必要なグルタチオンの還元に必要です。つまり、がん細胞のグルコース供給が不十分でペントース・リン酸経路でのNADPHの生成が不足すると、還元型グルタチオンの量が不足して、酸化傷害で死にやすくなります。
ケトン食はがん細胞のグルコースの利用を妨げ、エネルギー産生やNADPH生成を減らすので、高圧酸素で酸化ストレスが高くなると死滅することになります。
この理論に従うと、がん細胞の酸化ストレスを高める方法は、高圧酸素療法の代わりになると言えます。そのような方法として、ジクロロ酢酸ナトリウムやアルテスネイトや高濃度ビタミンC点滴などがあります。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化し、がん細胞のミトコンドリアを無理矢理活性化して酸化ストレスを高めます。
さらに、アルテスネイトや高濃度ビタミンC点滴もがん細胞の酸化ストレスを高めるのに有効です。
つまり、医療用の高圧酸素療法が行えない場合は、2-デオキシ-D-グルコース、ジクロロ酢酸ナトリウム、アルテスネイト、高濃度ビタミンC点滴などを併用すると、抗がん作用が期待できます。
2-デオキシ-D-グルコースは解糖系と同時にペントース・リン酸経路も阻害してHADPHの生成を減らします。
ペントース・リン酸経路では2カ所でNADPHが産生され、2-デオキシ-D-グルコース-6リン酸は最初のNADPH産生の代謝は受けますが2個目は反応が進まないため、NADPHの産生は半分になります。ただし、2-デオキシ-D-グルコース-6リン酸はヘキソキナーゼの活性を阻害するので、グルコース-6リン酸自体の生成を阻害するので、NADPHの産生を効率よく阻害することになります。
(2-デオキシグルコースに関してはこちらへ)がん細胞のグルタチオンを枯渇できれば、がん細胞は死滅します。グルタチオン合成を阻害する薬の臨床試験が行われていますが、有効性が認められているようです。
がん細胞により選択的に酸化ストレスを高める方法と、がん細胞の還元型グルタチオンの量を減らす方法を組み合わせれば、がん細胞の増殖抑制やがんの縮小効果が期待できそうです。そのような方法として、中鎖脂肪ケトン食、2-デオキシ-D-グルコース、スルファサラジン(サラゾピリン)、ジクロロ酢酸ナトリウム、アルテスネイト、高濃度ビタミンC点滴、半枝蓮などの組合せが想定されます。