ジスルフィラムの抗がん作用
【ジスルフィラムはアルコール依存症の治療薬】
ジスルフィラム(Disulfiram ;tetraethylthiuram disulfide) は、加硫促進剤や寄生虫疾患の治療薬(軟膏)など様々な領域で利用されている汎用性の高い物質です。ゴム処理労働者や疥癬患者が、アルコール飲料を飲んだあとに極めて強い有害反応を経験することが知られ、その原因がゴム処理過程で使用する加硫促進剤や疥癬の治療薬に含まれるチウラム・ジスルフィド(thiuram disulfides)に曝露されたことによることが70年以上前に明らかになりました。この発見により、ジスルフィラムは断酒薬として有用であることが示され、アルコール中毒の治療薬として認可され、60年間以上前から処方薬として使用されています。
ジスルフィラムはアンタビュース(Antabuse)の商品名で販売されています(ジェネリック医薬品も多く販売されています)。アルコールを飲むと強い副作用が出ますが、アルコールさえ飲まなければ、ジスルフィラムは極めて副作用の少ない薬です。
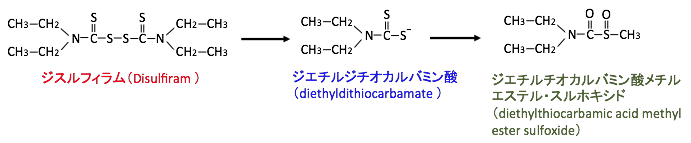
ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に速やかに変換され、さらにジエチルチオカルバミン酸メチルエステル・スルホキシド(diethylthiocarbamic acid methyl ester sulfoxide)に代謝されます(下図)。
図:ジスルフィラムを経口摂取すると、消化管内および血液内で1分子のジスルフィラムは2分子のジエチルジチオカルバミン酸(diethyldithiocarbamate)に速やかに変換される。ジスルフィラム由来のジエチルジチオカルバミン酸は、さらにジエチルチオカルバミン酸メチルエステル・スルホキシド(diethylthiocarbamic acid methyl ester sulfoxide)に代謝される。。
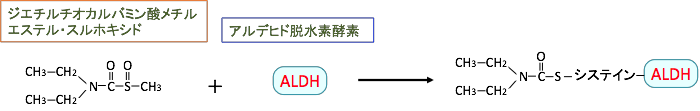
ジスルフィラムのこの代謝物(ジエチルチオカルバミン酸メチルエステル・スルホキシド)は、アルデヒド脱水素酵素(aldehyde dehydrogenase:ALDH)の酵素活性部位のスルフヒドリル基(-SH)と反応してALDHの酵素活性を強力に阻害する作用があります。(下図)
図:ジスルフィラムが分解されて生成したジエチルチオカルバミン酸メチルエステル・スルホキシドは、アルデヒド脱水素酵素(aldehyde dehydrogenase:ALDH)の酵素活性部位のシステインのスルフヒドリル基(-SH)と反応してALDHに結合し、ALDHの酵素活性を阻害する。
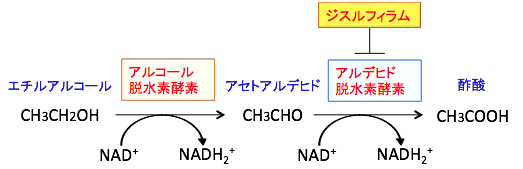
エチルアルコール(エタノール)はアルコール脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝されます。
アセトアルデヒドはタンパク質やDNAと反応してそれらの働きを阻害するので細胞毒性があります。アルデヒド基(-CHO)はタンパク質の側鎖のアミノ基と反応して結合します。病理検査で組織を固定する時にホルマリン(ホルムアルデヒドの水溶液)やグルタールアルデヒドを使用します。これは、ホルムアルデヒドやグルタールアルデヒドのアルデヒド基が組織のタンパク質のアミノ基と反応してタンパク質を架橋して凝固させる作用を持つからです。「タンパク質の架橋」というのは、異なるタンパク質分子に橋を架けるようにして結合させることです。架橋されたタンパク質は正常の働きを行うことができなくなります。
したがって、このような毒性の強いアセトアルデヒドを早く分解する必要があります。この有害なアセトアルデヒドを無害な酢酸に代謝する酵素がアルデヒド脱水素酵素 です。アルデヒド脱水素酵素の阻害剤であるジスルフィラムはアルコールの代謝でできるアセトアルデヒドの分解を阻害することによって、アセトアルデヒドの有害な症状がでるので、アルコールを飲めなくするのです(下図)。
図:エチルアルコール(エタノール)はアルデヒド脱水素酵素でアセトアルデヒドに代謝され、アセトルデヒドはアルデヒド脱水素酵素によって酢酸に代謝される。ジスルフィラムはアルデヒド脱水素酵素を阻害する。アセトアルデヒドは毒性が強いので、細胞や組織にダメージを与える。
【ジスルフィラムはがん細胞の酸化ストレスを高める】
同様なメカニズム(タンパク質のシステインに反応して活性を阻害する機序)によって、プロテインキナーゼCやP糖蛋白質やDNAメチルトランスフェラーゼを含む、様々ながん促進性のタンパク質を阻害します。
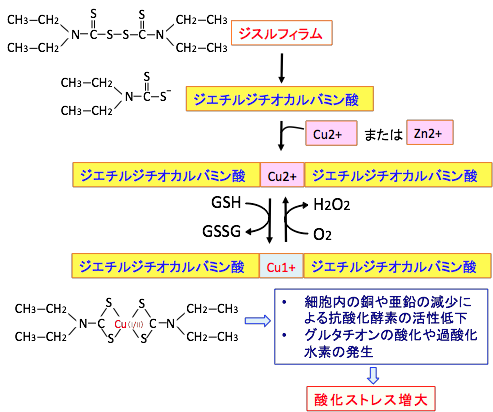
ジスルフィラムの代謝物は銅イオンや亜鉛イオンと複合体を形成するため、細胞内の重金属イオンの貯蔵量を減らし、その結果、スーパーオキシド・ディスムターゼ(酸化ストレスから細胞を保護する)やマトリックス・メタロプロテイナーゼ(がん細胞の浸潤や転移を促進する)やドーパミンβ-モノオキシゲナーゼ(コカイン依存に関与)のような酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用があります。
ジスルフィラムの抗腫瘍効果は二価重金属の存在下で強く現れます。がん細胞内には正常細胞よりもこのような二価の重金属(銅や亜鉛)が多く存在するので、ジスルフィラムの毒性はがん細胞に強くでます。
ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオンの酸化と過酸化水素の産生を引き起こし、細胞内の酸化ストレスを高めることになります。
図:ジスルフィラムの代謝産物のジエチルジチオカルバミン酸は二価の重金属(銅や亜鉛)と複合体を形成する。その結果、細胞内の重金属イオンの貯蔵量を減らし、酵素活性に亜鉛や銅が必須の酵素の活性を阻害する作用がある。また、ジスルフィラムと銅イオンの複合体内における一価の銅イオンCu(I)と二価の銅イオンCu(II)の酸化還元サイクルは、グルタチオン(GSH)の酸化と過酸化水素(H2O2)の産生を引き起こし、細胞内の酸化ストレスを高める。がん細胞内には正常細胞よりもこのような二価の重金属が多く存在するので、ジスルフィラムの毒性はがん細胞に強く出る。
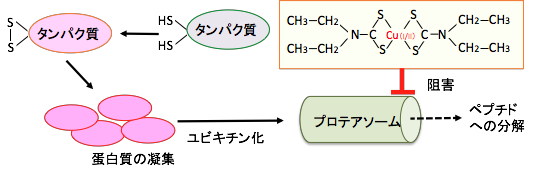
ジスルフィラムと銅の組合せ(複合体)はプロテアソーム(proteasome)におけるタンパク質の分解機能を強力に阻害する作用があります。プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する系はユビキチン-プロテアソーム・システムと呼ばれ、細胞周期やシグナル伝達やアポトーシスなど細胞内の様々な機能の制御に関わっています。
プロテオソームの働きが阻害されると細胞内タンパク質の恒常性に異常が起こり、ユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によってがん細胞に対して致死的に作用します。 すでに、プロテアソーム阻害剤は抗がん剤としても使用されています(ボルテゾミブ)。 つまり、ジスルフィラムはプロテアソーム阻害作用による抗がん作用もあるということです。
図:スルフヒドリル基(-SH)が酸化されたタンパク質は凝集しプロテアソームで分解される。プロテアソームはタンパク質分解活性を持った巨大な酵素複合体で、ユビキチンにより標識されたタンパク質をプロテアソームで分解する。ジエチルジチオカルバミン酸と銅の複合体はプロテアソームにおけるタンパク質の分解機能を強力に阻害する。 プロテオソームの働きが阻害されるとユビキチン化されたタンパク質が細胞内に増え、毒性の強い凝集したタンパク質によって致死的に作用する。
ジスルフィラムはアルコール依存症の治療に60年以上も使用され、アルコールを摂取しなければ安全性には問題がありません。 また、血液脳関門を通過できるので、脳腫瘍の治療にも利用できます。
【ジスルフィラムはがん幹細胞の抗がん剤感受性を高める】
アルデヒド脱水素酵素(ALDH)は4量体の酵素で、アルデヒド(CHO)を酸化してカルボン酸(COOH)にする反応を触媒する酵素です。アルデヒト脱水素酵素はがん幹細胞のマーカーとしても知られています。つまり、アルデヒト脱水素酵素はがん幹細胞に過剰に発現し、その生存や増殖や自己複製に何らかの重要な働きを行っていることが指摘されています。
細胞にとってアルデヒドは毒性があるので、アルデヒドを早く代謝するために必要なのかもしれません。 多くのがん種においてALDH活性の高いがん細胞は増殖や転移を促進することが報告されています。 乳がんや卵巣がんなどで、ALDH活性の高い腫瘍は生存期間も短く予後が悪いことが報告されています。 ALDHの活性を阻害すると転移能を抑制できるという報告もあります。 次の様な論文があります。
ALDH Activity Correlates with Metastatic Potential in Primary Sarcomas of Bone.(骨の原発性肉腫においてアルデヒド脱水素酵素の活性は転移能と相関する) J Cancer Ther. 5(4):331-338. 2014年 【要旨】
骨肉腫、軟骨肉腫、ユーイング肉腫は骨を原発とする悪性腫瘍であるが、比較的稀な疾患である。他の全ての肉腫と同じように、これらの悪性腫瘍の予後は転移があるかどうかによって決まる。すなわち、これらの悪性腫瘍の生存率は腫瘍細胞の悪性度や転移能が重要な決定要因となる。
骨を原発とする肉腫の連続した10例の解析によって、肉腫の遠隔転移の有無が腫瘍細胞のアルデヒド脱水素酵素の活性と密接な関連を示すことが明らかとなった。 さらに、培養したヒト軟骨細胞肉腫を用いた実験で、軟骨細胞肉腫は一般的には抗がん剤や放射線治療に対して抵抗性であるが、アルデヒド脱水素酵素の阻害剤であるジスルフィラムを投与すると、抗がん剤や放射線治療に対する軟骨細胞肉腫の感受性が高まることが示された。骨由来の肉腫におけるアルデヒド脱水素酵素の活性が転移能と密接に関連し、この酵素の阻害による治療の可能性を検討する必要がある。骨肉腫や軟骨肉腫やユーイング肉腫の最も多い転移部位は肺で、その他、骨やリンパ節などに転移します。 一般的な治療は、術前の抗がん剤治療に広範な切除、さらに術後の抗がん剤治療です。しかし、軟骨肉腫は抗がん剤にも放射線治療にも抵抗性します。したがって、ジスルフィラムが骨由来の肉腫の抗がん剤感受性を高めるという報告は役に立ちます。
ジスルフィラムは様々な種類のアルデヒト脱水素酵素を阻害する作用があります。
前述のように、ジスルフィラムとその代謝物は、がん細胞内の酸化ストレスを高めます。 がん幹細胞は抗がん剤治療に抵抗性を示しますが、ジスルフィラムでアルデヒト脱水素酵素を阻害すると、がん幹細胞が死にやすくなることが報告されています。 卵巣がん細胞を使った実験では、ジスルフィラムは銅イオンに依存するメカニズムでがん細胞内の酸化ストレスを高め、異常なタンパク質の凝集やヒートショック応答遺伝子の発現を引き起こして、卵巣がん細胞に顕著で不可逆的なアポトーシス(細胞死)を誘導する作用が認められています。
酸化ストレスの亢進に対して細胞は内因性の抗酸化物質の量を増やすことによって細胞を守ろうとします。このような抗酸化物質は、フリーラジカルを直接消去するようなものであったり、酸化したジスルフィド結合(S-S)に水素を与えて還元する(-SH)作用を持つもの(NADPHのようなもの)になります。
細胞内の酸化還元常状態の恒常性維持には2つのシステムが主要な貢献を行っています。その2つというのはグルタチオンとチオレドキシン・システムです。この2つの抗酸化システムはがん細胞において過剰に発現しています。その理由は、がん細胞ではその特徴的な代謝によって活性酸素の産生が亢進しており、それに対抗して細胞を守るためです。
培養がん細胞株を用いた実験で、ジスルフィラムはシクロフォスファミドやシスプラチンや放射線による殺細胞作用を増強する作用が認められています。動物実験では、抗がん剤のがん細胞に対する治療効果を高め、腎臓や胃腸や骨髄などの正常細胞は保護する作用が示されています。
【ジスルフィラムはトリプル・ネガティブの乳がんの抗がん剤感受性を高める】
抗がん剤治療の問題は、固形がんに対しては抗がん剤の効き目は弱いということです。それは、がん細胞が抗がん剤に対して、様々なメカニズムで抵抗性を示すからです。その抵抗性を源弱あるいは阻止できれば、抗がん剤治療の効果を高めることができます。そのターゲットの一つとしてアルデヒド脱水素酵素があります。
乳がんのがん幹細胞はアルデヒド脱水素酵素の発現が亢進していることが報告されています。ジスルフィラムのがん幹細胞に対する選択的な作用はトリプル・ネガティブの乳がん細胞でも示されています。ジスルフィラムはがん幹細胞をターゲットにして、抗がん剤感受性を高めます。 (トリプル・ネガティブというのは、エストロゲンとプロゲステロンとHer2に対する受容体を欠如した乳がん細胞で、ホルモン療法やハーセプチンが効かない乳がんです)
トリプル・ネガティブの乳がん細胞は、一般的に抗がん剤治療に抵抗性で予後は不良ですが、このような治療抵抗性のトリプル・ネガティブの乳がん細胞の抗がん剤感受性を高める方法としてジスルフィラムが有効です。 ジスルフィラムの誘導体のditiocarbをもちいたランダム化臨床試験では、乳がん患者の抗がん剤治療で5年生存率を高める効果が認められています。 アルデヒド脱水素酵素の発現が高い乳がんは予後が悪いことが報告されています。以下のような論文があります。
Changes in aldehyde dehydrogenase-1 expression during neoadjuvant chemotherapy predict outcome in locally advanced breast cancer. (局所進行性の乳がんにおいて術前化学療法中のアルデヒド脱水素酵素-1の発現の変化は予後を予想させる因子となる) Breast Cancer Res. 2014 Apr 24;16(2):R44. doi: 10.1186/bcr3648.
【要旨】
イントロダクション:局所進行性の乳がんに対して行われる術前化学療法は、がんを縮小させることによって手術の根治性を高めることができる。しかしながら、抗がん剤治療に対する効果や長期生存率を予測できるマーカーがない。アルデヒド脱水素酵素-1(aldehyde dehydrogenase-1;ALDH1)の発現は、乳がん組織におけるがん幹細胞の自己複製能や抗がん剤抵抗性の性質と関連していることが指摘されている。そこで、術前化学療法を受けた乳がん組織におけるALDH1の発現と治療効果との関連を検討した。
方法:局所進行性の乳がんの女性を無作為に2群(AとB)に分け、A群はアントラサイクリンをベースにした抗がん剤治療を4サイクル受けたあとにタキサン治療を4サイクル受けた。B群は順番を逆にして(タキサン治療の後にアントラサイクリン)化学療法を受けた。 腫瘍組織は、治療前、4サイクルの抗がん剤治療後、手術切除時の3時点で採取した。 ALDH1発現量は免疫染色で評価し、腫瘍の縮小率や生存率との関連を統計的に解析した。
結果:119例の乳がん患者がこの臨床試験に参加した。57例(48%)はA群に、62例(52%)はB群に割り振られた。 90%の患者は腺管がん(ductal carcinoma)で10%が小葉がん(lobular carcinoma)であった。このうち、26例(22%)は術前化学療法で病理学的完全奏功を認めた。 術前のALDH1の発現レベルと腫瘍のグレード、ステージ、ホルモン受容体の状況、ヒト上皮成長因子2(HER2)の発現レベル、Ki67指数との間には相関を認めなかった。 治療前のALDH1の発現陰性は病理学的完全奏功と相関を認めた(P=0.004)。 縮小を認めなかった症例において残存した腫瘍細胞におけるALDH1陽性細胞の存在は全生存率の減少を強く示唆した(P=0.024)。 さらに、縮小を認めなかった症例からの経時的に採取した腫瘍組織では、腫瘍特異的なALDH1の発現の顕著な増加を認めた(P=0.028)。 全体として投与した抗がん剤の順番に関しては生存率に違いは認めなかった。しかしながら、ドセタキセルによる抗がん剤治療を受けて縮小しなかった腫瘍組織にはALDH1発現の顕著な増加を認めた。
結論:ALDH1の発現は抗がん剤抵抗性を予測する有用な指標であった。局所進行乳がん患者において、術前化学療法でALDH1の発現が上昇を認めた場合は、予後不良を示唆した。抗がん剤治療の順番は予後には影響しないが、今回の結果は、ALDH1陽性の乳がん細胞をターゲットにする場合、アントラサイクリンをベースにした抗がん剤治療の方がタキサン系よりもより有効であることを示唆している。。
アルデヒド脱水素酵素クラス1(ALDH1)はがん幹細胞で発現量や活性が高く、 薬剤耐性と関連しており、したがって、治療前にALDH1の発現が多い乳がんは抗がん剤治療に抵抗性を示し、抗がん剤治療後にALDH1陽性のがん細胞が増えている場合は、ALDH1陽性が抗がん剤治療中も増殖していることを意味するので、転移や再発のリスクが高いと言えます。つまり、この様な場合は予後不良を示唆します。
したがって、乳がんの術前化学療法を含めて、再発や転移した乳がんの抗がん剤治療にALDH1阻害作用を示すジスルフィラムの併用は効果が期待できます。
◉ ジスルフィラムのプロテアソーム阻害作用がトップレベルの学術雑誌のNatureに報告されています(詳細はこちらへ)
◉ 治療に関するご質問やご相談などは、電話(03-5550-3552)またはメール(info@f-gtc.or.jp)でお問い合わせ下さい。