Medical Marijuana for Cancer(がん治療のための医療大麻)
Joan L. Kramer MD CA Cancer J Clin 65: 109–122. 2015年
アメリカがん協会(American Cancer Society)は1913年に設立されたアメリカ合衆国の非営利団体で、全米3400か所に支部を有しています。最新の治療法や患者会の案内など患者支援のきめ細かい情報を提供しています。この論文はアメリカがん協会が発行する学術雑誌に報告された「がんと医療大麻」に関する最新の総説です。
【要旨】
大麻は古くから使用されており、近年、その医療用途に対する関心が増えている。
このような大麻の医療用途に関する研究から、ドロナビノールやナビロンやナビキシモルスのようなカンナビノイド製剤が開発された。
ドロナビノール(Dronabinol)は抗がん剤治療に伴う吐き気や、後天性免疫不全症候群(AIDS)の患者における食欲不振と体重減少に対する治療薬として多くの研究が行われ、米国の食品医薬品局(FDA)からこれらの治療薬として承認されている。
ナビロン(Nabilone)は抗がん剤治療による吐き気の治療薬として主に研究されている。
ドロナビノールとナビロンは他の症状に対する効果についても検討されている。
ナビキシモルス(Nabiximols)はアメリカ合衆国では治験でしか現時点では利用できないが、カナダと英国では多発性硬化症の筋肉硬直(痙縮)や痛みの治療薬として使用されている。
大麻の研究は吐き気や食欲や疼痛に関するものが多い。
この論文では、大麻とカンナビノイド製剤の医療使用に関する論文(特にがん治療に関するものを中心にして)を論評し、さらに大麻使用に伴う有害作用に関する情報についてもまとめている。
【イントロダクション】
米国において多くの州で大麻の医療使用を合法化する法律が可決されており、病気の治療における大麻の効果に関する正確な情報が必要とされている。
医療用の大麻製剤と非医療用の大麻製品を病気の治療に用いるかどうかの選択に患者と医師は直面している。
このような選択に情報を与える目的で、大麻とカンナビノイド製剤に関する査読学術論文を探索し、論評を行った。
カンナビノイド製剤に関するこの論評は、米国医薬品局(FDA)やその他の国のFDAに相当する機関によってこれらのカンナビノイド製剤が承認されている地域に住んでいる患者や医師に役に立つ。
この大麻に関する論評は、大麻の推奨や購入や所持や使用が刑事罰の対象にならない地域に住んでいる患者や医師の選択を助けることを意図している。
大麻の使用を推奨したり(あるいは推奨しなかったり)するものではなく、またそのような大麻の使用に関連する法的政策や規制政策に言及するものではない。
【背景】
大麻:
大麻草(Cannabis sativa)の乾燥した葉であるマリファナ(Marijuana)は、娯楽および病気の治療の目的で古くから使用されてきた。[1]
(Cannabis afghanicaやCannabis indicaのように精神活性作用の強い大麻の品種がそのような目的で使用されているが[2]、本論文ではカンナビス(cannabis)という用語はCannabis sativaを意味している。)
アメリカ合衆国では大麻の使用は、20世紀初期に次第に規制されるようになった。はじめは様々な州の法律で規制され、1937年には連邦法であるマリファナ課税法(the Marihuana Tax Act)が制定された。
マリファナ課税法の制定以降は、特定の適用法の変更はあったが、マリファナの製造、輸入、所持、使用、配布は連邦法の下では違法になっている。
この時点で、米国麻薬取締局(the US Drug Enforcement Administration)は、大麻とその成分のカンナビノイドをスケジュールIの規制物質に分類した。スケジュールIの規制物質は、連邦法の下では薬として処方することができない物質である。
スケジュールIというのは:1)乱用の危険性が高い、2)アメリカ合衆国内において承認された医療用途がない、3)医療目的で使用する際の安全性が確認されていない。
他のスケジュールI物質にはヘロインや3,4-methylenedioxy-N-methylamphetamine(MDMAやエクスタシーと呼ばれる)が含まれるが、コカインはスケジュールIIの規制物質である[3]。
マリファナに含まれるカンナビノイドはスケジュールI物質であるが、幾つかの合成カンナビノイドはスケジュールIではない(後で考察する)。
マリファナはスケジュールI規制物質であるため、医師やその他の医療従事者が処方箋に記載すれば連邦法の下では処罰される。
多くの州で、マリファナの医療使用を許可する法律が制定されている。
これらの州では、医師と患者のコミュニケーションを保護する連邦裁判所の判決によって、医療従事者が医療大麻を使用することが承認されている。[1]
大麻からカンナビノイドを濃縮した状態で含む大麻樹脂や大麻オイルが作られる。大麻樹脂や大麻オイルは吸入(喫煙や気化吸入)や経口(お茶や食品に混ぜて)で摂取される。
大麻の喫煙は、その精神活性作用のあるカンナビノイド成分だけでなく、タバコの煙同じような化学成分も多く含む。
これらの成分のなかには、4-アミビフェニール(4-aminobiphenyl)、ヒ素、ベンゼン、カドミウム、ホルムアルデヒド、鉛など人間に対して発がん性があるもの含まれている。
さらに大麻喫煙の煙にはアンモニア、一酸化炭素、シアン化水素、タールのような毒性物質も含まれている。
タバコと違って、大麻喫煙の煙にはニコチンやタバコ特有のニトロサミン(ニコチンに由来する成分)は含まれていない。[4]
変異原性試験では、大麻の煙の濃縮物は、タバコの煙の濃縮物に匹敵する、あるいはやや少ない変異原性を示したが[5]、フィルターのついたタバコの喫煙に比べると、一酸化炭素ヘモグロビンのレベルや吸入されたタールの量や、肺に沈着するタールの量は大麻喫煙の方が高い。[6]
これは、1回の喫煙の量や、吸入の深さや、吸い込んだあとの保持の時間などの違いにも依存してくる。[6,7]
180から200℃の間の温度で加熱して気化した大麻成分を吸入する方法だと、十分な量のカンナビノイドが放出され、その他の不要な成分の放出はわずかである。[8,9]
大麻の吸入の方法として、喫煙に代わる手段として気化吸入が使用されている。カンナビノイド受容体とカンナビノイド:
大麻(Cannabis sativa)には多くの化学成分が含まれているが、そのうちある種のものはカンナビノイドと呼ばれている。
カンナビノイドは大麻草に特異的に含まれる炭素数21個のテルペノフェノリック化合物の総称として最初に使われた。これらのカンナビノイドは脳などに存再するカンナビノイド受容体に結合して受容体を活性化する働きが発見された。
現在では、化学構造に類似性が無くても、このような受容体を活性化する他の物質もカンナビノイドという名称で呼ばれる。[10]
主なカンナビノイド受容体は2種類が知られており、CB1とCB2と呼ばれている。
CB1受容体は主に中枢神経系と末梢神経に存在し、CB2受容体は主に免疫細胞に存在している。[10]
これらのカンナビノイド受容体とこの受容体に結合して活性化する内因性のアゴニスト(内因性カンナビノイドと呼ばれ、体内で産生されてカンナビノイド受容体を活性化する)が内因性カンナビノイド・システムを構築している。[10]
大麻には60種類以上のカンナビノイドが見つかっているが[10]、そのうち医療目的での使用に関して最も研究されているはデルタ-9-テトラヒドロカンナビノール(Δ9-THCあるいは単にTHCと略される)とカンナビジオール(CBD)の2つである。
THCは大麻の主要な精神活性成分で、大麻吸入で感じる「ハイ」な気分の原因成分である。このような多幸的感覚を引き起こす作用に加えて、THCは鎮痛、制吐(吐気止め)、抗炎症、抗酸化などの効果を有する。[10]
CBDは大麻草に含まれる主要成分である。CBDは、カンナビノイド受容体のCB1とCB2に対する親和性はほとんどなく、低濃度ではCB1/CB2受容体アゴニスト(受容低に結合して作用する物質)の働きを阻害するアンタゴニストとして作用し、逆アゴニスト(受容体に結合してその受容体の活性化を阻害する物質)としても作用する。[11]
過去においては、CBDは精神作用は無いと言われていたが、CBDには抗不安作用や抗精神病作用が明らかになっている。さらに、CBDは抗けいれん作用があり、THCの精神活性作用を緩和する作用も有する。[10,12]
CBDは鎮痛作用も報告されているが、この作用は抗侵害受容作用というよりも抗けいれん作用と関連している可能性がある。
カリフォルニア州で押収されたマリファナの解析によると、重量当たりのTHCの含量が年々上昇していることが報告されており、1996年の4.18%から2008年は13.95%になっている。
対照的に、CBDの含量は減少している。その結果、THC:CBD比は増えている。[13]
CBDが高含有量でTHCが低含有量の大麻の株が栽培され、難治性てんかんの小児の治療に使われている。[14,15]
大麻はスクジュールI規制物質であるため、大麻を使った研究では国立薬物濫用研究所(the National Institute of Drug Abuse :NIDA)から入手しなければならない。
NIDAから入手できる大麻の株を使用した研究には多くの制限がある。2014年の7月にNIDAの代表は、臨床試験用に使用されている様々な大麻の品種のTHCの含有量は0.001%kら13%まで大きな幅があることを報告している。
その当時、NIDAから入手できる大麻で、CBD含有量が高い品種は無く、2015年の段階でも入手はできなかった。デルタ-9-テトラヒドロカンナビノール(Delta-9-tetrahydrocannabinol):
THCは高度に脂溶性で水には溶けない。
大麻を喫煙すると、大麻成分は急速に血液中に吸収され、吸入後数秒で血液中に検出されるレベルに達し、数分から10分程度で血液中濃度はピークに達する。
THCの血液中の濃度は喫煙した大麻のTHC含量と直接関連する。[7]
大麻を喫煙した場合のTHCの生体利用率(体内への吸収率)は、煙の吸入の深さや量や呼吸止めの時間などによって変動し、通常は10%から35%の間と推定されており、たまに喫煙する人よりも喫煙の回数の多いヘビーユーザーの方が体内吸収率が高い。
大麻をタバコで喫煙するよりパイプで喫煙する方が副流煙で損失するTHCの量が少ないので、THCの吸収量はパイプの方が高くなる。[7]
大麻成分を気化させて吸入する(vaporization)臨床試験では、大麻喫煙より一酸化炭素の血中レベルは低く、血液中のTHC濃度は大麻喫煙に匹敵するレベルに達する。[9]
経口摂取した場合のTHCの体内吸収に関する研究は主に合成THC製剤のドロナビノールで行われている。大麻を加えた焼いた食品を用いた研究は少数しかない。
経口摂取後の吸収は「ゆっくりで不安定(slow and erratic)」と表現され、血液中のTHC濃度は「低く、不規則(low and irregular)」である。
THCは酸で分解されやすいので、胃の胃酸で利用できるTHCの量は減少する。
大麻成分は初回通過代謝(first-pass metabolism)を強く受ける。[17]
(訳者注;初回通過代謝とは、経口摂取で吸収されたものが、肝臓などで分解されて、全身循環に回る前に活性成分が減少すること)
経口摂取されたあと、血液中の濃度は通常は60分から120分でピークに達するが、人によっては血液中濃度がピークに達するのに4時間以上かかる場合もある。
さらに、1回の経口摂取で血液中の濃度のピークが1回以上になる場合もある。[7]
経口摂取による生体利用率は約6%と報告されているが、個体間にかなりの変動がある。[7]
THCは口腔粘膜から吸収させることもできる。
THCを含む大麻抽出エキスを舌下に投与すると、45分程度で血液中に検出できるレベルに達する。THCの検出は舌下投与後30〜120分の範囲で、血液中濃度のピークは100〜130分後である。濃度の濃いエキスを投与するとピークに達する時間が遅くなる。[18]
経口で服用した場合のTHCの薬物動態の研究において、大麻抽出エキス(ナビキシモルス)として投与されたTHCの方が、THCを単独で服用した場合に比べて、最大濃度までの時間が増加した。しかし、この差は統計的に有意ではなかった。
内服するより口腔内粘膜から吸収させた方が生体利用率はわずかであるが向上した。[19]
口腔粘膜へのスプレー投与を摂食状態中(食事をした直後)に行うと、最大血中濃度や吸収量から計算したTHCの生体利用率は増加した。[20]
血液中では、THCの90%は血清中に分布し、リポタンパクやアルブミンなどの血清タンパク質と結合して存在する。
血液中のTHCの約10%は赤血球に分布している。
THCは、肝臓、心臓、脂肪、肺、小腸、腎臓、乳腺、胎盤、副腎皮質、筋肉、甲状腺、下垂体などの血管の豊富な組織に急速に浸透していく。
精神活性作用がピークに達している時点で、静脈注射で投与されたTHCのわずか1%程度が脳に分布している。
THCの代謝によって精神活性作用の高い代謝産物の11-ヒドロキシ-デルタ-9-テトラヒドロカンナビノール(11-hydroxy-delta 9-tetrahydrocannabinol;11-OH-THC)が産生される。
時間が経過すると、THCは血管が乏しい組織にも蓄積するようになり、最終的には体脂肪に蓄積する。
しかしながら、体脂肪における正確な分布はよく分っておらず、水酸化された代謝産物や脂肪酸が結合した物などが存在する可能性がある。[7]
大麻を喫煙したとき、THCの血中レベルは6から10分でピークに達し、11-OH-THCは9から23分でピークになる。
大麻を喫煙したあと、精神活性作用のピークは20〜30分で起こり、45分から60分間、あるいはそれ以上持続する。その持続時間は喫煙した大麻のTHC含量に依存する。[7]
大麻を経口摂取した場合の血中濃度は異なり、THCの血中濃度のピークは摂取して数時間後であり、11-OH-THCの血中濃度はTHCのそれよりも高くなる。精神作用は経口摂取後30〜90分で出始め、2から4時間でピークになり、6時間後以降は低下する。[7]
THCは胎盤を通過し、母乳にも少量移行する。[7]カンナビジオール(Cannabidiol):
カンナビジオール(CBD)も高度に脂溶性である。大麻喫煙によるCBDの吸収や動態はTHCと類似しており、全身にける生体利用率は平均31%(11%〜45%)と言われている。[7]
THCと同様に、CBDの経口摂取での生体利用率は低く、13%から19%程度である。[21]
一つの研究では、CBDの経口摂取での血液中濃度のピークは1.3時間後というデータが報告されている。[19]
経口粘膜スプレーで投与した場合、CBDとTHCを一緒に投与した場合のピークの血液中の濃度はCBDだけの場合とほぼ同じであるが、CBDとTHCの混合のスプレーの方が最大濃度に達するまでの時間が長い。[19]
口腔粘膜へのスプレー投与を摂食状態中(食事をした直後)に行うと、最大血中濃度や吸収量から計算したCBDの生体利用率は増加した。[20]カンナビノイド製剤:
2つのカンナビノイド製剤が米国食品医薬品局(FDA)から承認されており、これらは連邦法の下でアメリカ合衆国内で合法的に処方が可能である。
一つはドロナビノール(dronabinol)で、これは胡麻油に溶解してTHCのトランス異性体(trans isomer)をゼラチンのカプセルに入れている。
ドロナビノールのTHCは化学合成したものである。この薬は2つの適用疾患がFDAから承認されている。すなわち、1)抗がん剤による吐き気と嘔吐、2)後天性免疫不全(AIDA)患者における体重減少を伴った食欲不振の2つである。[22]
もう一つの薬はナビロン(nabilone)と言い、THCの作用を真似た合成カンナビノイドである。ナビロンは抗がん剤による吐き気と嘔吐の治療薬としてFDAから承認されている。
これら2つのカンナビノイド製剤はカプセルとしてのみ使用される。
ナビロンはスケジュールII規制物質に分類されており、ドロナビノールはスケジュールIII規制物質に分類されている。
これらのカンナビノイド製剤は経口で投与され胃から吸収される必要があるため、また経口摂取では血液中の濃度がピークに達する時間が長いため、吐き気や嘔吐の治療薬としての有用性は低下している。
他の注目すべきカンナビノイド製剤はナビキシモルス(nabiximols)である。ナビキシモルスは大麻の全草の抽出エキスでTHCとCBDを1.08:1.00の比率で含有している。これは、口腔粘膜スプレーとして投与される。[19]
この薬は疼痛に対する治療薬として米国では臨床試験が行われている段階であるが、カナダとヨーロッパの幾つかの国では、多発性硬化症の筋肉硬直(痙縮)の治療薬として使用が承認されている。
カナダではさらに、ある種の疼痛の治療に対しても、条件付きで使用が認められている。
THCを含まないカンナビジオール含有液体は、小児てんかんの稀な疾患であるLennox-Gastaut症候群[24]とドラベ(Dravet)症候群[25]を治療する臨床試験のために、近いうちにアメリカ合衆国で使用できるようになる。
統合失調症患者に対するこの薬の第2相試験が現在進行中である。[26]
【がんにおける大麻とカンナビノイドの医療用途の可能性に関する論評】
大麻はスケジュールI規制物質に分類されているので大規模な臨床研究を行うのは困難であるが、大麻やTHC(デルタ-9-テトラヒドロカンナビノール)やカンナビノイド製剤は、多くの疾患や症状(吐気、疼痛、食欲不振、体重減少、痙攣、筋肉硬縮、緑内障など)に対する効果が検討されている。
この論評(レヴュー)では、主にがん患者における、吐き気や疼痛や食欲不振や体重減少の治療における大麻やカンナビノイドの使用について言及している。さらに、抗がん作用に関するカンナビノイドの臨床試験についても簡単に論評する。方法:
大麻とカンナビノイドの医療用途のエビデンス(証拠)を論評する目的で、PubMed(アメリカ国立医学図書館の国立生物工学情報センター(NCBI)が運営する医学・生物学分野の学術文献検索サービス)で、「marijuana(マリファナ)」「cannabis(大麻)」「delta-9-tetrahydrocannabinol」「dronabinol」「nabilone」「nabiximols」「cannabidiol」のキーワードで検索した。
このPubMedの文献検索では臨床試験に関する英文の論文を対象にし、がん患者における吐き気、嘔吐、疼痛、食欲不振や体重減少に対する大麻やカンナビノイド製剤の使用に関する研究結果を探索した。
PubMedの文献検索をさらに広げるために、総説論文の引用文献やメタ解析や治療ガイドラインを探索して、臨床試験の情報を検索した。吐き気と嘔吐:
大麻:
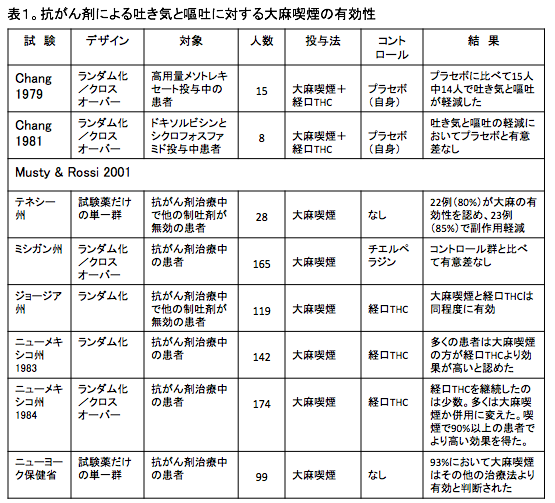
PubMedの文献検索では、抗がん剤治療に伴う吐き気と嘔吐に対する大麻喫煙の効果に関する臨床試験は2件が見つかった。
この2件の臨床試験は、個々の患者において、大麻喫煙とプラセボの効果を比較するものであった。
一つの試験では、高用量のメソトレキセートを投与された15人の患者を対象に、経口THCと大麻喫煙の効果が検討された。
15人中14人において、THCと大麻喫煙はともにプラセボ群よりも抗がん剤による吐き気と嘔吐の軽減において有効性が示された。
この研究ではTHCの血中濃度が測定されており、THCの濃度が高いほど制吐作用の効果は高かった。[27]
もう一つの研究はドキソルビシンとシクロフォスファミドによる抗がん剤治療をうけた8例のがん患者の検討で、この試験ではプラセボ群に比べて経口THCと大麻喫煙は吐き気と嘔吐を軽減する効果は認められなかった。[28]
2001年にMustyとRossiは、州健康局(state health department)によって実施された抗がん剤治療による吐き気と嘔吐に対する大麻の効果を検討した多数の研究結果をまとめている。しかし、この結果は学術論文として報告されていないのでPubMedの文献リストには入っていない。
幾つかの研究では、経口THCと大麻喫煙が併用された。
他の研究では、経口THCと大麻喫煙の効果が比較された。
幾つかの研究では対照群がなく、1つの研究では、制吐作用のあるフェノチアジン(phenothiazine)が実薬対照(active control)として検討されたり、経口THCを実薬対照として検討されたものもあった。
これらの臨床研究において、抗がん剤治療における吐き気と嘔吐の軽減に関して、それまで使用されていた治療法に比べて大麻喫煙がより有効性が高いことが明らかにされた。少なくとも大麻喫煙は経口THCやフェノチアジンよりも有効であった。(表1)[27-29]
カンナビノイド製剤:
抗がん剤による吐き気と嘔吐に対する経口THCの効果に関しては、ドロナビノールの多くの臨床試験で示されている。
それらの研究の幾つかはプラセボ対照の臨床試験であり[30-33]、2つの研究においては自身を対照にしている。[30,32]
幾つかの臨床試験では実薬(prochlorperazine,[31, 33-38] haloperidol,[37, 39] metoclopramide, [34, 40] または ondansetron[41])と比較されている。
一つの臨床試験では、ドロナビノールは有効であったが、何人かの患者は副作用の観点からプラセボ(偽薬)の方を好んだ。[32]
ドロナビノールとプロクロルペラジン(prochlorperazine)の併用は、それぞれ単独で使用するよりも、有効性が高いことが示された。[42]
しかし、別の臨床試験では、遅延性嘔吐に対して、ドロナビノールとオンダンセトロン(ondansetron)の併用は、それぞれ単独で使用した場合の効果を超えることはできなかった。[41]
ドロナビノールが放射線治療に伴う吐き気の抑制に有効であることが一つの臨床試験で示されている。[43]
16例の患者を対象にしたプラセボ対照試験で、抗がん剤治療(中等度の吐き気を引き起こすレジメ)後の遅延性嘔吐に対するナビキシモルス(nabiximols)の効果が検討された。
この試験で、急性の嘔吐(抗がん剤投与後24時間以内に起こる嘔吐)には効果は無かったが、遅延性嘔吐(24時間後以降に起こる嘔吐)に対しては、プラセボより高い有効性が示された。[44]
抗がん剤治療に伴う吐き気と嘔吐に対するナビロンの効果に関しては多数の臨床試験が行われている。
これらの臨床試験の多くはクロスオーバー試験(被検薬と対象薬を時期ずらして投与)で行われている。
3つの臨床試験で、ナビロンはプラセボより有効であることが示された。[45-47]
ナビロンの単独投与と、metoclopramide,[48] prochlorperazine,[49-55] domperidone,[56, 57] , alizapride,[55, 58]のような実薬(既に効果が証明されている医薬品)と比較する臨床試験が多く行われている。その結果、ナビロンはこれらの薬と同等あるいは一部ではより有効性が高いことが明らかになった。
しかしながら、傾眠、体位性のめまいと低血圧、もうろう状態、多幸感、,[53, 56, 58, 59]そして稀に幻覚[49, 55]といった中枢神経系の副作用が、対照の薬よりもナビロンの方が強くでる傾向にあった。
抗がん剤による吐き気と嘔吐に対する治療において、ナビロン単独よりもナビロンとデキサメサゾンの併用の方がより有効であることが示されている。そして、この併用の方が副作用も少なかった。[59]
しかしながら、別の試験では、ナビロンとプロクロルペラジン(prochlorperazine)の併用はナビロン単独より高い効果は示されなかった。[60]
別の臨床試験では、シスプラチンを含む抗がん剤治療による嘔吐に対して、ナビロンとプロクロルペラジンの併用療法は、デキサメサゾンとメトクロプラミド(metoclopramide)の組合せより有効性は低かった。[61]
一つの臨床試験で、ナビロンは放射線治療による嘔吐に対してメトクロプラミドと同等の有効性を示したが、副作用の頻度と程度はナビロンの方が多かった。[62]
別の研究では、至急摘出手術を受けた女性の術後の吐き気と嘔吐の治療において、ナビロンはメトクロプラミドと同等の効果が認められた。[63]疼痛:
大麻:
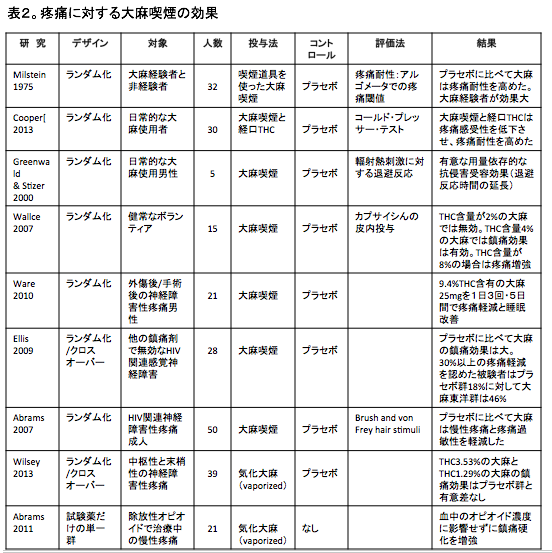
現時点では、実験的に発生させた疼痛に対する大麻喫煙の効果を検討した数件の研究が報告されている。
一つの研究では、大麻喫煙は疼痛耐性を改善した。[64]
別の実験では、4℃の冷水に手や足を浸して痛みを発生させるコールド・プレッサー・テスト(cold pressor test)において、大麻喫煙は疼痛感受性や疼痛強度を低下させ、疼痛耐性を高めた。[65]
別の試験では、輻射熱刺激(radiant heat stimulation)に対する逃避の反応時間で評価する抗侵害受容効果を大麻喫煙は高めた。[66]
皮下にカプサイシンを注入して痛みを発生させる実験で、中等量の大麻は疼痛を軽減し、高用量の大麻は逆に疼痛を増強した。(表2)[64-72]
実験的に発生させた疼痛以外ので大麻喫煙の研究は、主に神経障害性疼痛において検討されている。
一つの研究では、手術後や外傷後の疼痛が検討された。[68]
別の研究では、ヒト免疫不全ウイルス(HIV)関連性の感覚神経障害の疼痛が検討された。[69,70]
これらの全ての研究において、疼痛緩和において大麻喫煙はプラセボよりも有効であることが示された。
別の研究では、喫煙ではなく気化させた大麻(vaporized marijuana)の効果が検討され、神経障害性疼痛(標準的な治療で緩和できない中枢性あるいは末梢性の神経障害性疼痛を有する患者)の緩和においてプラセボより有効であることが示された。[71]
慢性疼痛に対して徐放性オピオイドを使用している患者の疼痛に対して気化した大麻の摂取の効果を検討した小規模な臨床試験が報告されている。
この研究では、血液中のオピオイドの濃度に変化を及ぼすことなく、気化大麻の投与は疼痛を軽減することが示された。[72]カンナビノイド製剤:
がん性疼痛に対するナビキシモルスの臨床試験は現在までに数件の報告があるのみである。
一つの試験では、オピオイドで緩和できないがん性疼痛を有する患者を対象にしたランダム化試験で、ナビキシモルスと口腔粘膜投与のTHCとプラセボが比較された。この試験では、THCとプラセボ群では統計的に有意な差は認められなかったが、ナビキシモルスはプラセボ群よりも疼痛スコアの改善が認められた。[73]
さらに、この臨床試験は継続され、ナビキシモルスを摂取している患者では疼痛軽減が持続し、ナビキシモルスの用量を増やさなくても不眠や倦怠感の改善が認められた。[74]
オピオイドで緩和できない疼痛をもつ進行がん患者を対象にした別の臨床試験では、低用量と中等度の用量のナビキシモルスの摂取群ではプラセボ群に比べて高い鎮痛軽減の効果が認められた。[75]
神経障害性疼痛に対して、ナビキシモルスの臨床試験では、異なる結果が得られている。
二重盲検プラセボ対照クロスオーバー試験では、抗がん剤治療による神経障害性疼痛に対して、プラセボと比べて有効性は認められなかった。
しかしながら、16例中5例の患者が顕著な疼痛軽減(0から10までの11段階の疼痛スケールで2ポイント以上の軽減効果)を認めたので、論文の著者らは、さらに臨床試験を行う必要があると結論づけている。[76]
あるランダム化試験では、ナビシキモルスの投与期間中はプラセボ群と有意な効果は認められなかったが、薬の投与を中止している期間ではプラセボより高い鎮痛効果が認められたので、中枢性の神経障害性疼痛に対するナビキシモルスの効果ははっきりしないという結果になっている。[77]
別のランダム化試験では、多発性硬化症による中枢性神経障害性疼痛に対してナビキシモルスは改善効果を示した。[78]
この臨床試験の継続での調査では、疼痛軽減効果は持続した。[79]
ある臨床試験では、糖尿病性の疼痛性末梢神経障害の治療に対してはナビキシモルスはプラセボと差を認めなかった。[80]
しかしながら、他の臨床試験では、片側性あるいは末梢性の神経障害性疼痛の治療に対しては、アンナビキシモルスはプラセボより有効であった。[81]
この臨床試験において、神経障害の原因は外傷、感染後神経症、血管性神経症、特発性神経症であった。
リュウマチ性関節炎の患者を対象にした臨床試験では、ナビキシモルスは疼痛軽減と睡眠改善においてプラセボより有効であった。[82]
ドロナビノールも疼痛に対して検討されている。
一つの臨床試験では、非がん性の慢性疼痛の13例の患者のうち5例でドロナビノールは有効な反応を示した。[83]
非がん性の慢性疼痛を有し、すでにオピオイドで治療を受けている患者を対象にした別の臨床試験では、ドロナビノールはさらに鎮痛効果を増強し、プラセボ群より良い結果であった。[84]
がん性疼痛の患者を対象にした臨床試験では10mgのTHCは軽度の鎮痛効果を示した。[85]
プラセボ対照用量上昇試験において、プラセボより高い鎮痛効果はTHCの15mgと20mgの投与でのみ認められた。これらの用量はかなりの鎮静作用と意識混濁を引き起こした。[86]
子宮摘出の手術を受けた女性における手術後疼痛の治療においては、ドロナビノールはプラセボと差は認めなかった。[87]
神経障害性疼痛の患者を対象にしたドロナビノールの非盲検試験では、疼痛緩和、異痛症、生活の質、不安や抑うつ、生理機能などの観点で、ドロナビノールがプラセボ以上の効果を示すことはできなかった。[88]
7例の患者を対象にした小規模や予備試験では、脊髄損傷による中枢性神経障害の治療において、ドロナビノールはジフェンヒドラミン(diphenhydramine)に勝る効果は認められなかった。[89]
しかしながら、ドロナビノールは多発性硬化症の中枢性神経障害性疼痛の緩和においてはプラセボと比較して有効であった。[90]
脊髄損傷による痙縮と疼痛を有する患者を対象に、THCの効果がコデインおよびプラセボと比較された。THCとコデインは疼痛を軽減したが、痙縮を改善したのはTHCのみであった。[91]
抜糸後の疼痛に対してTHCを静脈注射で投与した小規模な臨床試験では、THCの効果は一定しなかった。この研究において、患者の多くは副作用の観点からTHCよりプラセボを好んだ。[92]
一つのプラセボ対照試験では、糖尿病性神経症による疼痛をナビキシモルスが改善することが示された。[93]
末梢性神経障害性疼痛の治療に対するナビロンとガバペンチン(gabapentin)の効果を比較した別の臨床試験では、この2つの治療薬の鎮痛効果はほぼ同じレベルであった。[94]
一つの臨床試験では慢性神経障害性疼痛に対してナビロンはプラセボ以上の効果は示さなかった。[95]
ナビロンは薬物の過剰使用による頭痛の治療においてイブプロフェンより有効であった。[96]
線維筋痛症による痛みの軽減において、ナビロンはプラセボよる有効であった。[97]
プラセボ対照二重盲検クロスオーバー試験において、上位運動神経病の患者における痙縮関連の疼痛をナビロンは軽減した。[98]
小規模なランダム化二重盲検クロスオーバー試験において、ナビロンが痙縮を軽減することが示された。[99]
しかしながら、ナビロンは手術後の急性疼痛の軽減には効果は認められず、むしろ疼痛スコアを悪化させる結果が示された。[100]
さらに、カプサイシン誘導性の疼痛や疼痛過敏の治療にはナビロンは有用でなかった。[101]
疼痛を実験的に誘導した別の試験では、女性において一部の効果(一過性の軽減)のみで有用であった
食欲低下と体重減少の治療:
大麻:
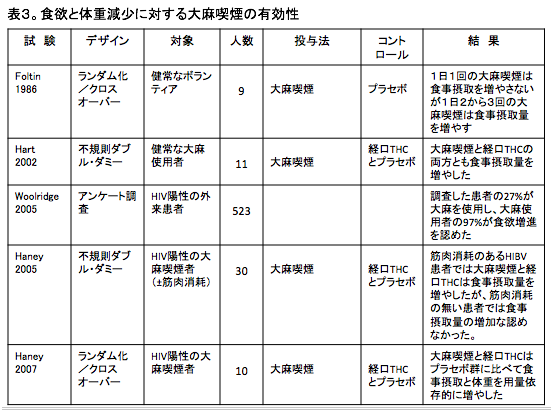
健康なボランティアにおける研究で、大麻喫煙は食事からの摂取カロリーを増やす。[103,104]
食欲に対する大麻喫煙の効果は主にHIV(ヒト免疫不全ウイルス)感染者で検討されている。
大麻の使用を報告しているHIV陽性の患者は、食欲増進と吐き気の軽減(さらにその他の症状も)に大麻が有効であることを示している。[105]
HIV陽性の慢性的な大麻使用者のプラセボ対照試験では、大麻喫煙が食事摂取量を増やす効果が認められている。[106,107]
この効果は食欲を制御しているグレリンやレプチンのようなホルモンの産生増加や、チロシンの低下を介している(表3)[103-108]
ドロナビノールのような経口THCは、HIV感染に関連した食欲不振や消耗状態の治療における有効性が検討されている。
過去の臨床試験で報告されている食事摂取と体重における経口THCの効果は大麻喫煙に匹敵する。[106,107]
酢酸メゲストロール(megestrol acetate)と比較した臨床試験では、THCの効果は750mgの酢酸メゲストロールに及ばず、体重増加は認められなかった。[109]
体重減少を訴えているHIV感染患者におけるプラセボとの比較研究では、経口THC製剤は食欲と吐き気を改善したが、体重増加には有意な効果は認められなかった。[110]
この臨床試験の継続後の結果では、ドロナビノールで治療を受けた患者は体重が維持されて安定していた。[111]
がん患者における検討では、一つの臨床試験では、ドロナビノールの味覚の改善に効果が認められている。[112]
第2相試験において、がん患者における食欲の改善に効果が期待できる可能性が示唆されたが、二重盲検試験ではプラセボより有効という結果は得られなかった。[113]
即時摂取量が減少しているか体重減少を認めるがん患者を対象にした臨床試験で、ドロナビノールと酢酸メゲストロールの効果が比較された。その結果、食欲の増進と体重増加においてはドロナビノールより酢酸メゲストロールの方が勝っていた。[114]
アルツハイマー病の疑いのある高齢患者を対象にした小規模な臨床研究では、ドロナビノールは食事摂取量を増やし、行動異常を減少させる効果が認められた。[115]抗がん剤としてのカンナビノイド:
多くのがん細胞にカンナビノイド受容体が発現しており[116]、そして動物実験(in vivo)や培養細胞を使った実験(in vitro)など前臨床試験で[116]、グリオーマ[117]、肝臓がん[118]、前立腺がん[119]、肺がん[120]、胆管細胞がん[121]、乳がん[122]、悪性黒色腫[123]などの悪性腫瘍に対してカンナビノイドが抗腫瘍効果を示すエビデンスが多く報告されている。
しかしながら、臨床試験に関してはまだ報告が少ない。
膠芽腫の患者における小規模な第1相試験で、THCの腫瘍内投与が安全に実施できることが示されている。[124]
他の臨床試験では、大麻のお茶が抗がん剤のドセタキセルやイリノテカンの薬物動態に影響しないことが報告されている。[125]
膠芽腫の治療におけるカンナビノイドの臨床試験が現在進行中である。[126, 127]
【大麻の有害作用】
発がん作用:
大麻を喫煙するとその煙の中には変異原性物質を含んでいるので、がんの発生を引き起こす可能性がある。しかしながら、この可能性に関する研究はほとんど無い。
大麻喫煙と発がんリスクの関係に関する研究の多くは、がんを発症した人と発症していない人で大麻喫煙の有無を比較する症例対照研究である。このような研究で、タバコの喫煙は重要な交絡因子であることが明らかになっている。さらに、このような後ろ向きの研究は、バイアスがかなり大きいことが指摘されている。
ある一つの症例対照研究では大麻喫煙と頭頚部がんの発症頻度の間に相関が認められているが[128]、その他の多くの研究では関連は認められていない[129-132]。
肺がんに関しては、タバコ喫煙の交絡因子を調整すると、大麻喫煙(たとえ1日1本の大麻タバコを30年間吸い続けても)と肺がん発症の間には関連が無いことが症例対照研究で明らかになっている。[132]
チュニジアとモロッコとアルジェリアで実施された別の症例対照研究では、大麻喫煙者に肺がん発送のリスク上昇が示唆されたが、大麻を喫煙している人の多くがタバコも喫煙しているので、この結果を正しく評価することはできない。[133]
軍隊の兵隊を対象にした最近のコホート研究では、調査の段階で50回以上大麻を喫煙した者は肺がんの発症リスクが高いという結果を示している。このリスク上昇はタバコ喫煙の影響を調整しても変わらなかった。しかし、この研究はある一時点の情報を解析しただけである。[134]
他のがんに関しては、2つの症例対照研究が、大麻使用者における精巣がんの発症リスクの上昇を示している。[135, 136]さらに、病院の患者を対象にした症例対照研究では、日常的な大麻の使用者は移行上皮がんの発症リスクが高くなることが示されている。[137]
しかしながら、これらの研究でがん患者と対象(コントロール群)がいずれもタバコ喫煙者が多い(90%以上)という状況がある。
経口の大麻摂取と発がんリスクに関する研究結果がや、気化した大麻摂取と発がんリスクに関する研究はまだ報告されていない。呼吸器系への問題:
大麻の喫煙は気道粘膜を障害し、慢性気管支炎の発症リスクを高める可能性がある。しかし、これらの症状は大麻の使用を中止すれば消失する。そして、大麻喫煙と慢性閉塞性呼吸器疾患の発症と大麻喫煙との明らかな関連は示されていない。[138]精神神経系の症状:
大麻使用による急性症状として、記憶や注意力や反応時間や追跡能や運動機能などの機能の低下が認められ、これらの症状はTHCの濃度に依存する。
このような症状は大麻喫煙では最初の1時間で最も顕著に現れ、経口摂取では1から2時間後に現れる。
これらの症状は3から4時間後にはほぼ消滅する。
しかしながら、認知機能の影響は、大麻使用の頻度や期間によって影響を受けることが知られている。
たとえば、1ヶ月に1回の大麻使用者に比べて大麻を毎日使用している人では、大麻喫煙後19時間後の注意力や執行能力のテストでの低下が著しい。
さらに、ヘビーユーザーでは、最後の服用からの認知機能の低下は7日間にも及ぶ。
ヘビーユーザーでは、同じTHCレベルでも、ある種の能力テストでの低下が軽減することがあり、これは認知機能に対する大麻の毒性に対して耐性ができることを示唆している。[139-141]
大麻中毒は多幸感を引き起こすが、人によっては不安や妄想や幻覚を引き起こすことがあり、精神病のような症状を呈することも報告されている。
通常、これらの症状は数分から数時間で消失するが、人によっては数日続くこともある。[142]
統合失調症の患者が自己治療で大麻を使用していることが報告されているが、臨床試験ではTHCは統合失調症の症状を悪化させる可能性が指摘されている。[143]
このような効果には遺伝的要因が関連している可能性が報告されている。[143]
実際、統合失調症を発症しやすい遺伝的形質と健康人における大麻使用との間には関連がある可能性が最近の研究で示唆されている。[144]その他:
その他の中毒性物質と同様に、大麻も運転技術を低下させ、交通事故を引き起こすリスクを高める。[145]
大麻は飲酒による機能低下をさらに悪化させ[146]、運転技能もさらに低下させる。[147,148]
妊娠中に大麻を使用すると死産のリスクが高くなることが報告されている。[149, 152]
妊娠中に大麻を使用すると子供の精神機能や行動に悪影響を及ぼす可能性が報告されている。[150]
娯楽用の大麻を長期間使用していると過度の嘔吐を引き起こす(cannabinoid hyperemesis syndrome)場合がある。この場合、大麻の使用を中止しないと再発のリスクが高い。[151]
まとめ:
大麻とカンナビノイド製剤は、がん患者を悩ます多くの症状を含め、様々な問題に役立つことができる。
カンナビノイド製剤に比べて大麻の臨床試験は少ない。この原因の一部は、大麻の医療使用において法的な規制が存在するためである。また、今日までに実施された大麻の臨床試験は対象人数が少ない小規模な試験が多い。
このように入手できるエビデンス(証拠)がまだ少ないことが、患者や医師が大麻使用に関して質の高い判断を行うときの妨げになっている。
多くの疾患の治療における大麻とカンナビノイド製剤に関する質の高い研究をさらに行うことによって、大麻の様々品種や株の臨床効果の違いやそれらの中に含まれる活性成分の作用をより明らかにできる。
そのような研究は、大麻とその活性成分をどのように投与するのが最も有効かを明らかにすることができる。
経口摂取と吸入における薬物動態の違いは、様々な適応疾患に対する臨床効果の違いを意味するかもしれない。
たとえば、吐き気や嘔吐の治療においては経口摂取の効果は弱い。吐き気や嘔吐の治療においては、大麻やカンナビノイドの吸入による摂取の方が経口摂取より効果が高い。
しかしながら、大麻喫煙の場合、煙には毒性物質や発がん物質を含んでいるので、より有害作用の少ない気化による吸入(vaporization)が大麻成分の吸入法として好ましい。
さらに、大麻やその成分のカンナビノイドの長期使用の効果に関する質の高い研究が必要である。
がんの転帰を検討する症例対照研究では交絡因子やリコールバイアス(recall bias; 過去の事柄を思い出す場合に生じるバイアス)などの問題があるので、前向きコホート研究を実施する必要がある。