電子を増やすと、がん細胞は自壊する:がん細胞を内側から崩す 「電子環境再設計」
ここで紹介するのは、抗がん剤治療のように「がん細胞を強く攻撃する」という発想とはまったく異なる考え方です。
がん細胞の中の状態を少しずつ整え、がん細胞自身が壊れやすくなる条件をそろえるというアプローチです。 条件がそろったとき、がん細胞は外から無理に叩かれなくても、 内側から、自分で崩れていきます。
電子というのは、私たちの体の中で、エネルギーを生み出す過程に必ず関わっている、ごく基本的な存在です。がん細胞では、この電子が多すぎる状態になっています。それが、がん細胞の弱点になります。
「なぜ電子が増えすぎるとがん細胞が不安定になるのか」、 「なぜある瞬間に一気に崩れてしまうのか」を説明していきます。 がん細胞は、力ずくで叩き壊すしかない相手ではありません。内部のバランスが崩れたとき、自ら崩れてしまう弱点を持っています。
「電子の流れ」としてがんを見たとき、「ミトコンドリアから崩す」、 「電子ががんを壊す」、 という発想が浮かび上がります。
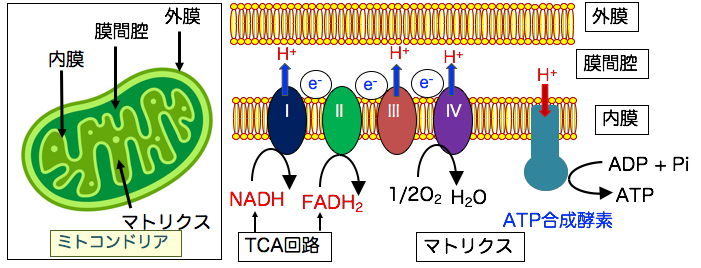
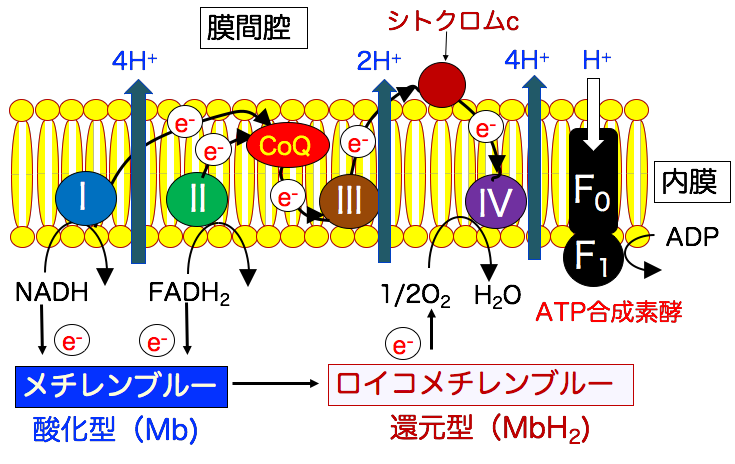
◉ ミトコンドリアの電子伝達系を電子が流れることでエネルギー(ATP)が産生される
ミトコンドリアでは、電子が流れることでATPが生み出されています。
TCA回路でNADHとFADH2に捕捉された高エネルギー電子は、ミトコンドリア内膜の電子伝達系(IからIV)に受け渡らされ、最終的に酸素(O2)が電子を受け取って水(H2O)になります。 この膜電位を利用してATP合成酵素でATPが生成されます。 (下図)
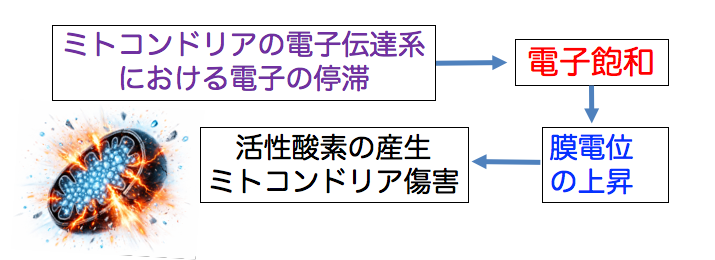
◉ がん細胞のミトコンドリアでは電子が渋滞している
がん細胞のミトコンドリアでは、電子伝達系における電子の流れが大きく歪み、電子が行き場を失って過剰に滞留する「電子飽和」という状態に陥っています。電子飽和はミトコンドリア膜電位を上昇し、活性酸素を産生してミトコンドリアを傷害します。
電子飽和は、がん細胞を不安定にし、酸化ストレスを高め、自ら崩れやすくしている弱点となります。(下図)
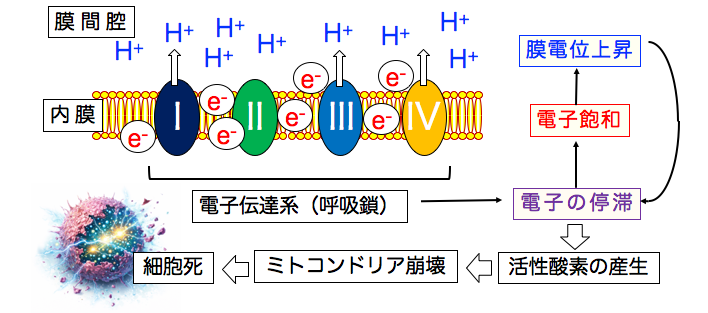
がん細胞の電子伝達系(呼吸鎖)は電子(e-)の流れが停滞し、電子飽和の状態にあります。電子が増えると 、膜間腔の水素イオン(H+)を増やして膜電位を上昇します。膜電位上昇はさらに電子の停滞を促進します。
その結果、活性酸素の産生が増加し、ミトコンドリアの酸化傷害による細胞死が引き起こされます。
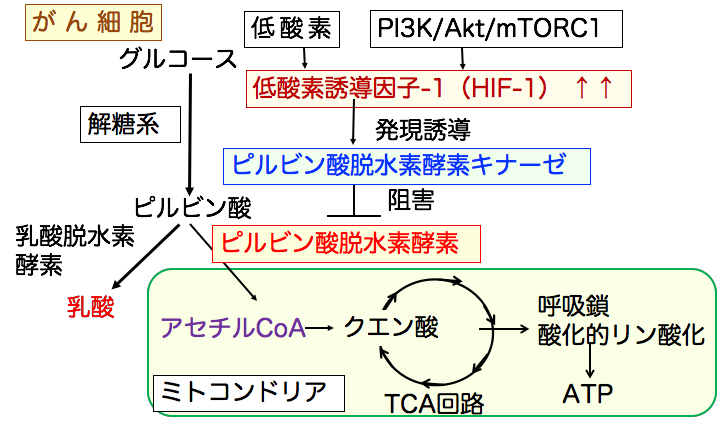
◉ がん細胞はミトコンドリアの酸化的リン酸化が抑制されている
グルコースは解糖系でピルビン酸に代謝され、 ピルビン酸脱水素酵素によってアセチルCoAに変換され、TCA回路、電子伝達系を経てATPが産生されます。
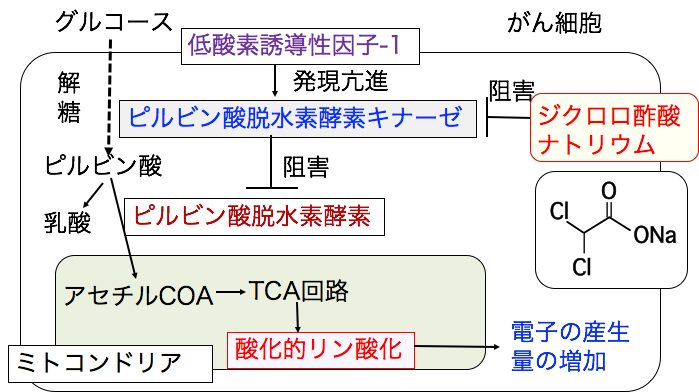
がん細胞では低酸素や増殖シグナル伝達系の活性化などによって低酸素誘導因子-1(HIF-1)の活性が亢進しています。 低酸素誘導因子-1(HIF-1)はピルビン酸脱水素酵素キナーゼの活性を亢進し、ピルビン酸脱水素酵素をリン酸化して活性を阻害します。 その結果、ミトコンドリアでの代謝が抑制されて、乳酸脱水素酵素によって、ピルビン酸から乳酸への産生が増えます。(下図)
◉ がん細胞のミトコンドリアは活性酸素が出やすい
細胞のエネルギーであるATP(アデノシン3リン酸)は、細胞質の解糖系とミトコンドリアでの呼吸鎖(酸化的リン酸化)によって産生されます。
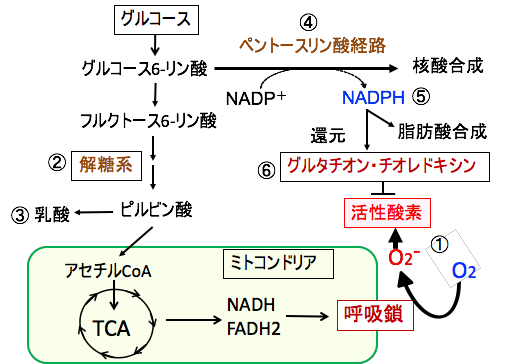
解糖系では酸素を使わずに、グルコース1分子当たり2分子のATPを産生します。一方、ミトコンドリアでは酸素を使ってグルコース1分子当たり30〜32分子のATPを産生できます。細胞内における活性酸素は、主にミトコンドリアにおける酸素を使ったエネルギー産生過程で発生しますが、正常細胞においては、ミトコンドリアにおける物質代謝やエネルギー産生過程は整然とコントロールされており、活性酸素の発生は最小限に抑えられています。
一方、がん細胞ではミトコンドリアに様々な異常が起こっています。ATPを産生する呼吸鎖にも異常が起こっており、酸素を使ったエネルギー産生過程で大量の活性酸素が産生されやすくなっています。これは、排気ガス処理装置が壊れた自動車が排気ガスをまき散らすのと同じ状態です。
つまり、がん細胞はミトコンドリアでの酸素消費を増やせば活性酸素の産生が増え、細胞が強いダメージを受け、自滅するリスクが高くなります。
がん細胞では酸素が十分に利用できる条件でも酸素を使わない解糖系でのATP産生を増やし、酸素を使ったミトコンドリアでのATP産生を抑制しています。これは活性酸素の産生を増やしたくないからです。ミトコンドリアでのエネルギー産生を抑制するため、エネルギー産生効率の悪い解糖系でエネルギー産生を行う必要があるために、グルコースの取り込みと解糖系の亢進が起こっているということになります。
またグルコース-6-リン酸からのペントースリン酸経路での代謝も亢進しており、この系で産生されるNADPHが細胞内の酸化ストレスを軽減するために利用されます。
つまり、がん細胞はミトコンドリアでの酸素呼吸を抑制することによって活性酸素の発生を防ぐ必要があるため、必然的に酸素を使わない解糖系の活性が亢進しているのです。 (下図)
図:がん細胞はミトコンドリアの呼吸鎖の異常によって、酸素を使ってATPを産生すると活性酸素の産生量が増える(①)。がん細胞は解糖系(②)が亢進し、乳酸(③)の産生が増えている。また、ペントースリン酸経路(④)が亢進し、この経路でできるNADPH(⑤)はグルタチオンやチオレドキシンを還元して活性酸素を消去する(⑥)。
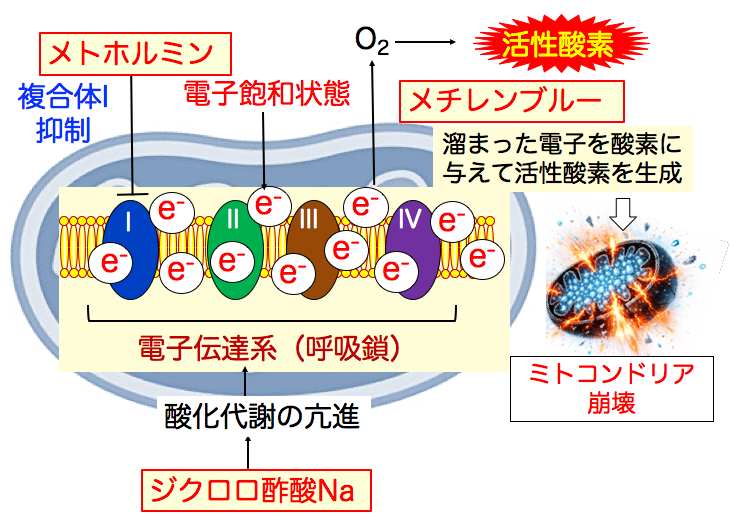
◉ ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素キナーゼを阻害する
グルコースが解糖系でピルビン酸に変換され、ピルビン酸脱水素酵素でアセチルCoAに変換されて、ミトコンドリアでの酸化的リン酸化へ進みます。 しかし、がん細胞では、低酸素誘導因子-1(HIF-1)の活性が亢進し、ピルビン酸脱水素酵素キナーゼの発現が増え、ピルビン酸脱水素酵素はリン酸化されて阻害されています。
ジクロロ酢酸ナトリウムは、ピルビン酸脱水素酵素キナーゼを阻害する作用があり、その結果、ピルビン酸脱水素酵素の活性を高め、ミトコンドリアの酸化的リン酸化を促進して、電子の産生を増やします。
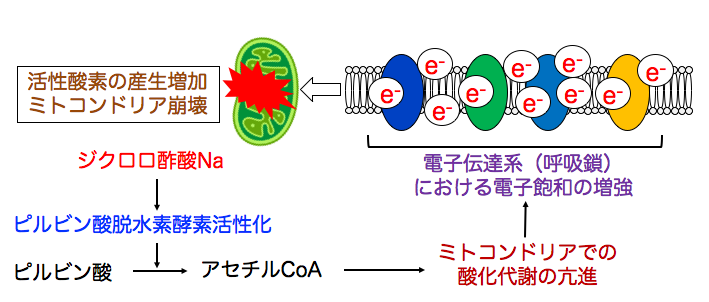
つまり、ジクロロ酢酸ナトリウムはミトコンドリアの酸化代謝を亢進してミトコンドリアの電子量を増やし、がん細胞における電子飽和を増強します。
ジクロロ酢酸ナトリウムはピルビン酸脱水素酵素を活性化し、 ピルビン酸からアセチルCoAの変換を促進します。 アセチルCoAはミトコンドリアの酸化代謝を亢進し、電子の産生を増やします。
その結果、がん細胞における電子伝達系の電子飽和を増強します。 このようにして、ミトコンドリアにおける活性酸素の産生が増加し、酸化傷害でミトコンドリアが崩壊して細胞死が誘導されます。
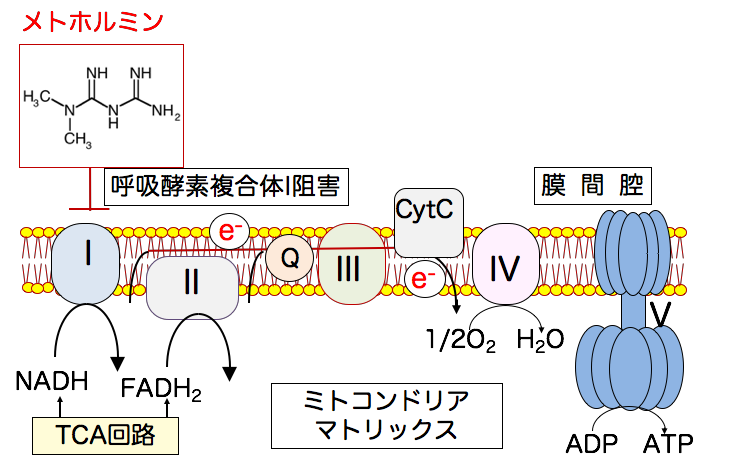
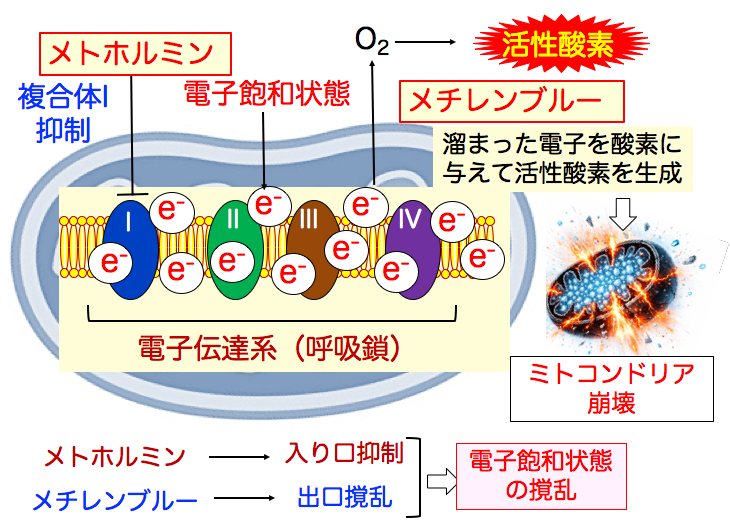
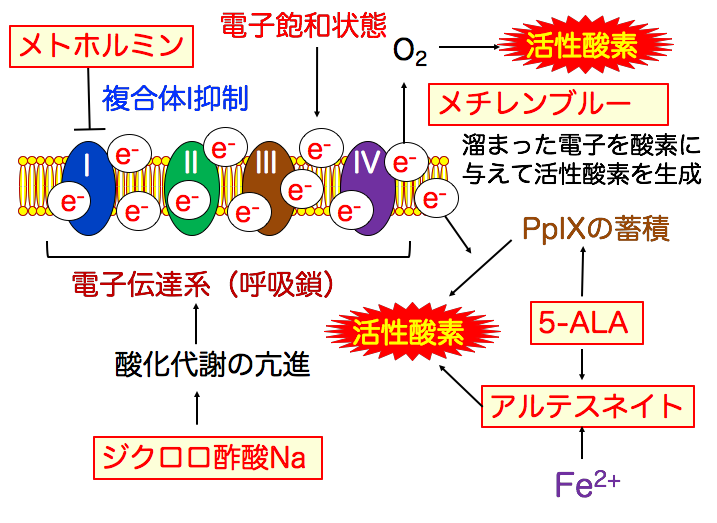
◉ メトホルミンはミトコンドリアの 電子の流れを低下する
糖尿病治療薬のメトホルミンは、ミトコンドリア呼吸酵素複合体Ⅰを部分的に抑制し、 電子伝達系の電子の流れを低下します。
複合体Ⅰでの電子の流入を制限することで、がん細胞のミトコンドリアは「電子の入口」と「出口」のバランスを崩されます その結果、電子の流れはより不安定になり、電子飽和状態が強調されます。
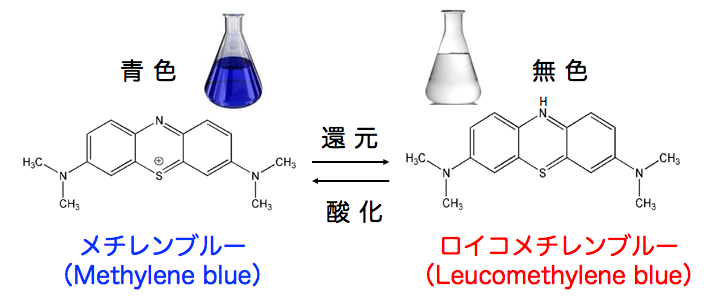
◉ メチレンブルーは溜まった電子を酸素に与えて活性酸素を発生する
メチレンブルーは、電子を「受け取ることも、渡すこともできる」という特殊な性質を持った酸化還元物質です。 電子を受け取ると無色の還元型(ロイコメチレンブルー)に変わり、別の分子に電子を渡すと再び元の酸化型(青色)に戻ります。 この性質によって、電子の流れが滞ったときに、その間をつなぐ補助役として働くことができます。
メチレンブルーは電子が滞留しやすい場所で電子を受け取り、電子伝達系の下流へと受け渡すことで、流れの偏りを和らげます。
がん細胞のミトコンドリアの電子伝達系は電子の流れが滞り、電子飽和の状態にあります。
メトホルミンは複合体1を抑制し、電子の流れを抑制します。
メチレンブルーはたまった電子を酸素に与えて、活性酸素を生成します。その結果、ミトコンドリアは活性酸素によるダメージを受け、崩壊します。
つまり、電子伝達系において、メトホルミンは入口を抑制し、 メチレンブルーは出口を撹乱し、 その結果、電子飽和状態を撹乱して、ミトコンドリアを不安定にします。
メトホルミンはミトコンドリア呼吸鎖の複合体Ⅰの活性を部分的に抑制し、電子を流しにくくすることで、代謝全体に減速をかけます。
メチレンブルーは電子伝達系の途中で滞留している電子を受け取り、酸素へと受け渡します。電子が過剰に溜まりやすいがん細胞では、活性酸素発生を引き起こします。
ジクロロ酢酸ナトリウムは抑え込まれていたピルビン酸脱水素酵素を再活性化します。その結果、解糖系で生じたピルビン酸はアセチルCoAとしてミトコンドリアに流入します。がん細胞において電子と炭素を“無理やり押し込む薬”として働きます。(下図)
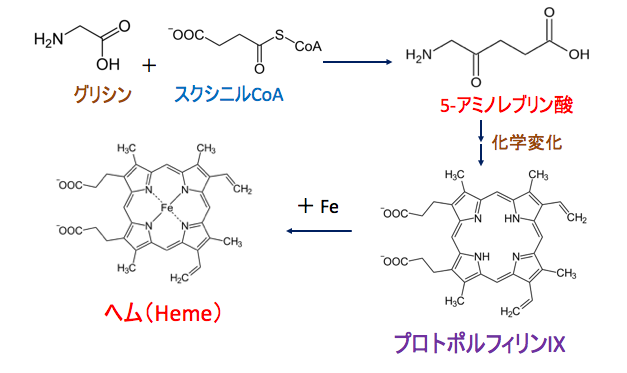
◉ 5-アミノレブリン酸はプロトポルフィリンIXの前駆体
5-アミノレブリン酸はミトコンドリア内でグリシンとスクシニルCoAから合成され、プロトポルフィリンIXとヘムに代謝されます。
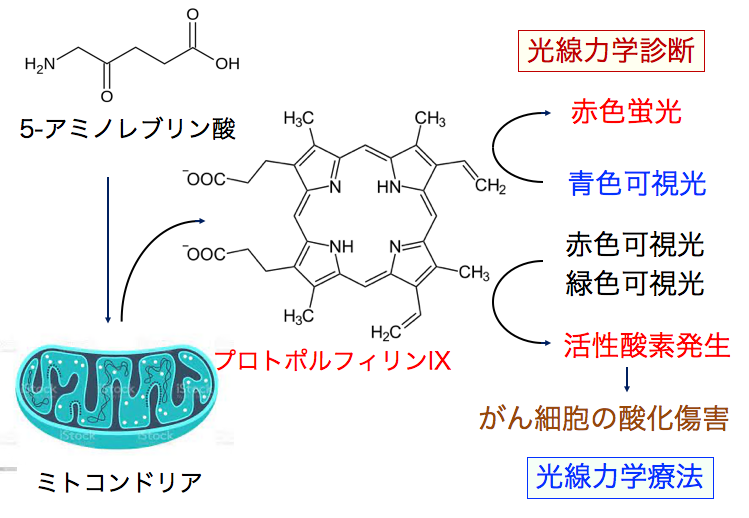
5-アミノレブリン酸を投与すると、がん細胞のミトコンドリアではプロトポルフィリンIXが過剰に蓄積します。 プロトポルフィリンIXは青色可視光で励起すると赤色蛍光を発光します。この蛍光をがん細胞の存在部位の確認に利用することを光線力学診断といいます。
赤色可視光あるいは緑色可視光で励起するとプロトポルフィリンIXは活性酸素を発生し、がん細胞を酸化傷害によって死滅します。これを光線力学療法と言います。
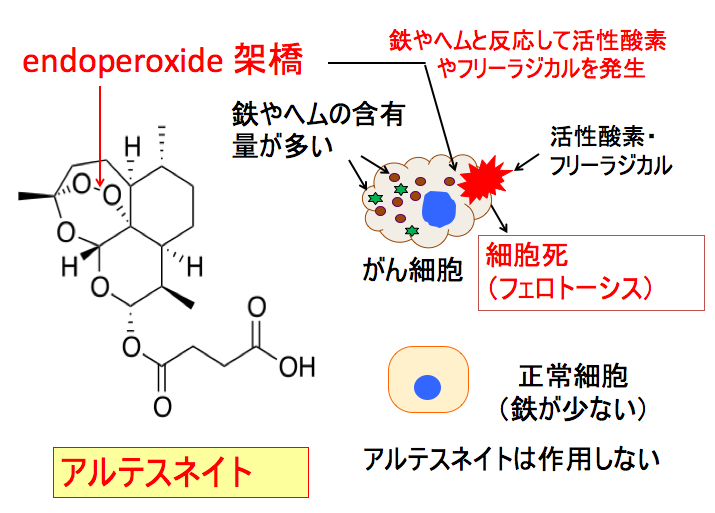
◉ アルテスネイトは鉄やヘムと反応して活性酸素を発生する
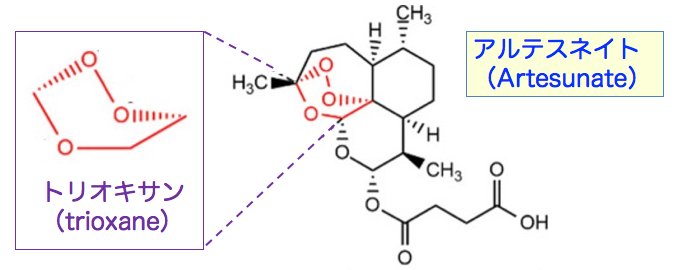
アルテスネイトはマラリアの治療薬です。 アルテスネイトは分子構造内にトリオキサン(trioxane)構造を有します。 このトリオキサンは3つの酸素原子を含む環状構造を持つ化合物です。 この構造がアルテスネイトの薬理作用と関連します。
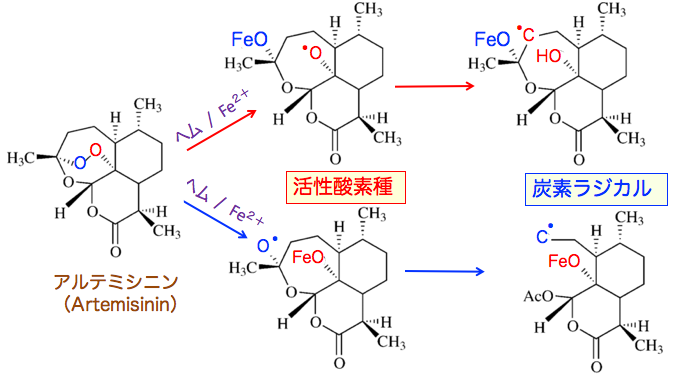
すなわち、トリオキサン環のエンドペルオキシド架橋がヘムや鉄イオンで開裂すると活性酸素種を生成します。 エンドペルオキシド架橋が開裂して活性化したアルテスネイトは、活性酸素種の生成だけでなく、様々なタンパク質のアルキル化や、DNAや細胞膜のダメージによって抗腫瘍活性を示します。
下の図において、エンドペルオキシド架橋の青い酸素にヘムの鉄イオンがアタックすると、赤い酸素がフリーラジカルになり、のちに炭素ラジカルが形成されます。
エンドペルオキシド架橋の赤い酸素にヘムの鉄イオンがアタックすると、青い酸素がフリーラジカルになり、のちに炭素ラジカルが形成されます。
つまり、アルテスネイトがヘムや鉄イオンと反応すると、酸素ラジカルや炭素ラジカルが発生します。
アルテスネイトは分子構造内にエンドペルオキシド架橋を有します。
がん細胞は鉄やヘムが多い特徴があります。 アルテスネイトのエンドペルオキシド架橋に鉄やヘムが反応すると活性酸素やフリーラジカルを発生します。 その結果、がん細胞はダメージを受け、細胞死を引き起こします。
一方、正常細胞は鉄が少ないので、アルテスネイトによるダメージは受けません。
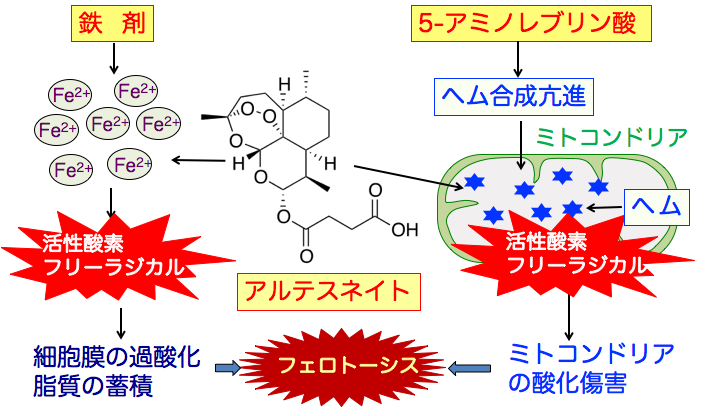
鉄剤とアルテスネイトを投与するとがん細胞に鉄が多く取り込まれ、アルテスネイトと反応して活性酸素やフリーラジカルを発生させて、細胞膜の過酸化脂質が蓄積してフェロトーシスによる細胞死を誘導します。
一方、5-アミノレブリン酸はヘムの合成を促進し、ヘムはアルテスネイトと反応して活性酸素やフリーラジカルを発生してミトコンドリアを崩壊して細胞死を誘導します。
つまり、アルテスネイト + 5-アミノレブリン酸 + 鉄剤はがん細胞のフェロトーシスによる細胞死誘導を増強します。
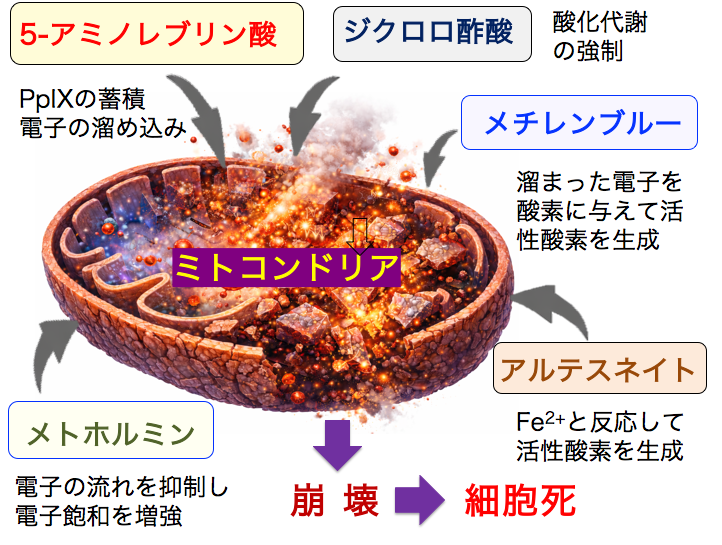
◉ がん細胞の電子飽和を増強すると、内部から崩れる
がん細胞の電子伝達系は電子飽和状態にあります。
5-アミノレブリン酸はプロトポルフィリン・ナインに変換されてミトコンドリアに蓄積し、 電子と反応して活性酸素を発生します。
ジクロロ酢酸ナトリウムは酸化代謝を亢進して電子を増やします。
メトホルミンは複合体Iを抑制し、 メチレンブルーは溜まった電子を酸素に与えて活性酸素を生成します。
アルテスネイトは鉄イオンと反応して活性酸素を発生し、5-アミノレブリン酸もプロトポルフィリンIXを増やしアルテスネイトによる活性酸素発生を亢進します。
このように、それぞれ異なる機序で、ミトコンドリアの電子飽和と活性酸素産生を促進して、ミトコンドリアを崩壊します。
5-アミノレブリン酸はプロトポルフィリンIXをミトコンドリア内に蓄積し、電子を溜め込みます。
ジクロロ酢酸は酸化代謝を強制的に増やします。
メチレンブルーはたまった電子を酸素に与えて活性酸素の産生をふやします。
アルテスネイトは鉄イオンと反応して活性酸素を発生します。
メトホルミンは電子の流れを抑制し、電子飽和を増強します。
これら5つを同時に行うとがん細胞のミトコンドリアは活性酸素の急激な発生によって崩壊し、がん細胞は死滅します。
◉ がん細胞を不安定にする5つの条件:
外からの攻撃に対して、がん細胞は案外しぶとく耐えます。 しかし、いくつかの条件が同時に重なったとき、 がん細胞は急に不安定になり、 ある瞬間を境に内側から崩れます。以下の5つの条件が重なったとき、がん細胞は内側から崩れていきます。
条件① エネルギーが作られすぎている:
がん細胞は、とにかくエネルギーを欲しがります。 その結果、必要以上にエネルギーを作り続け、 細胞の中に余りが生じます。 これは、 「必要以上に荷物を積み込んだトラック 」、「倉庫に入りきらない在庫 」のような状態です。 エネルギーが多いこと自体は、 一見、良いことのように見えます。 しかし、多すぎるエネルギーは不安定さの原因になります。
条件② エネルギーの流れが詰まりやすい:
本来、 作られたエネルギーは、 スムーズに使われていきます。 ところが、がん細胞では、 この流れがうまく進みません。 例えるなら、 「高速道路が渋滞して、車が前に進めない状態」です。 作られ続けるエネルギー、進めない流れ。 この組み合わせによって、 細胞の中ではミトコンドリア膜圧が高まり続けることになります。
条件③ 中で火花が起きやすくなっている:
エネルギーが余り、 流れが詰まると、 細胞の中ではトラブルが起きやすくなります。 それは、 エネルギーが本来とは違う形で暴れ出すことです。 例えるなら、 「混み合った配線から ・小さな火花が散る」ような状態です。 この小さな火花が増えてくると、 細胞の中は一気に危険な状態へ近づいていきます。
条件④ 元に戻す力が弱っている:
健康な細胞には、 多少のトラブルが起きても 元に戻す力があります。 しかし、がん細胞では、 この立て直す力が弱くなっています。 「小さな異常を処理できない」、「火花を消しきれない」という状態です。 その結果、 問題が積み重なっていきます。 これは、 消火器が足りない建物のようなものです。
条件⑤ これらが「同時に」起きている:
ここが最も重要な点です。 これまでの4つの条件は、 どれか一つだけなら、 がん細胞は何とか耐えることがあります。 しかし、エネルギーが余り 、電子の流れが詰まり、火花が起きやすく、消す力が弱いという条件が同時にそろった瞬間、 がん細胞は急激に不安定になります。 そして、 ほんの小さなきっかけで、 連鎖的な崩れが始まります。
なぜ「少しの刺激」で崩れるのか? この段階まで来たがん細胞は、 すでに限界の手前にいます。 だからこそ、 大きな力は必要ありません。少し揺れる 、少し増える、少し乱れる、 それだけで、 がん細胞は自分の内側から崩れ始めます。
がん細胞は、 一撃で壊されるのではありません。 不安定な条件が重なった結果、 自分で崩れてしまう。
「電子環境再設計」 というがん治療法が目指しているのは、 がん細胞にこの「不安定な条件」を 静かにそろえていくことです。