イトラコナゾール(Itraconazole)の抗がん作用
● 水虫治療薬のイトラコナゾールは多彩なメカニズムで抗がん作用を発揮する
イトラコナゾールは、水虫等の白癬菌症、口腔や食道カンジダ症等に広く使用されている真菌治療薬です。真菌のステロール生合成経路においてラノステロール(lanosterol)から エルゴステロール(ergosterol)を生成する cytochrome P450 14a-demethylase (P45014DM)という酵素を阻害します。エルゴステロールは真菌細胞膜の主成分であるため、エルゴステロールが生成されないと細胞膜を作れないので真菌は死滅します。
イトラコナゾールには強力な血管新生阻害作用が報告されています。
さらに、哺乳類ラパマイシン標的タンパク質複合体1(mTORC1)シグナル伝達系阻害作用、ヘッジホッグシグナル伝達系の阻害作用、コレステロールの細胞内輸送を阻害する作用、ミトコンドリアのVDAC1(電位依存性陰イオンチャネル)の働きを阻害する作用などが報告されています(下図)。

● コレステロールの細胞内輸送の阻害はmTORシグナル伝達系と血管新生を阻害する
イタラコナゾールはニーマン・ピック病C1型(NPC1)の原因タンパク質のNPC1のステロール感知ドメイン(SSD)に結合し、NPC1によるコレステロール輸送を妨害します。その結果、リソソームでのコレステロールの蓄積と細胞内コンパートメントでのコレステロールの枯渇が誘導され、mTORC1シグナル伝達系と血管新生が阻害されます。

図:リソソーム内に輸送されたLDL(低密度コレステロール)はリソソームの酸性リパーゼによって加水分解されて遊離コレステロールとなる(①)。コレステロールは、リソソーム内腔のニーマンピック病C型(NPC)NPC2に結合し(②)、リソソームの内膜側にあるNPC1のN末端ドメイン(N-terminal domain:NTD)に転移する(③)。コレステロールはNPC1のN末端ドメイン(NTD)からステロール感知ドメイン(sterol-sensing domain :SSD)に転送され(④)、リソソームから細胞質に輸送される(⑤)。イトラコナゾールはNPC1のステロール感知ドメイン(SSD)に結合し、NPC1によるコレステロール輸送を妨害する(⑥)。その結果、リソソームでのコレステロールの蓄積と細胞質内のコレステロールの枯渇が誘導され(⑦)、mTORC1シグナル伝達系が阻害される(⑧)。
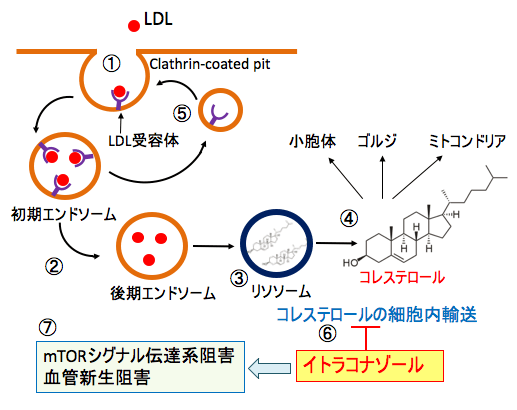
図:血液中のコレステロール(低密度リポタンパク質(LDL)-コレステロール)は、細胞膜のクラスリン被覆ピット(clathrin-coated pits)のLDL受容体に結合し、エンドサイトーシスを介して細胞内に移行する(①)。 その後、エンドソームは成熟し(②)、リソソームと融合する(③)。リソソームでは、リソソームの酵素によって遊離コレステロールが細胞質へ放出され、細胞小器官(小胞体、ゴルジ、ミトコンドリア)と原形質膜に輸送される(④)。 解離した受容体は細胞膜へ戻され、再利用される(⑤)。イトラコナゾールはリソソームから細胞質へのコレステロールの細胞内輸送の過程を阻害し(⑥)、その結果、mTORシグナル伝達系と血管新生を阻害し、がん細胞の増殖を抑制する(⑦)。
● イトラコナゾールはヘッジホッグシグナル伝達系を阻害する
ヘッジホッグシグナル伝達系の活性亢進は、がんの発生過程だけでなく、より浸潤性の高いがん細胞への変化や抗がん剤治療への抵抗性を引き起こしています。したがって、この経路を阻害すると、がん細胞の増殖や転移を抑制し、抗がん剤治療が効きやすくなることが予想できます。
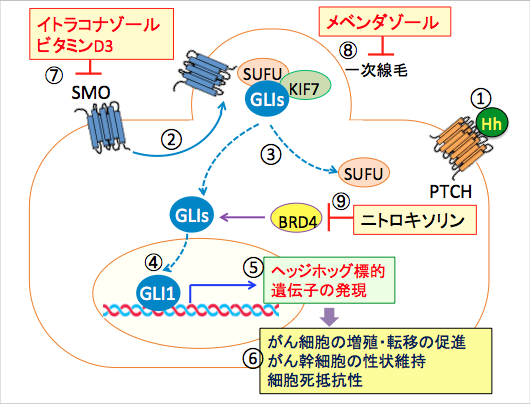
図: 2回膜貫通型受容体のPatched-1(PTCH-1)にヘッジホッグ(Hh)結合すると(①)、7回膜貫通型のGiタンパク質共役受容体のSmoothened (SMO)は一次線毛に移行し(②)。GLIがSUFUから離れてフリーになり(③)、核に移行して(④)、ヘッジホッグ標的遺伝子の発現を亢進する(⑤)。その結果、がん細胞の増殖・転移の促進、がん幹細胞の性状維持、細胞死抵抗性の亢進が引き起こされる(⑥)。イトラコナゾールとビタミンD3はSMOに結合して、一次線毛への移動を阻害してSMOの働きを阻害してヘッジホッグシグナル伝達系を阻害する(⑦)。メベンダゾールは微小管重合を阻害して一次線毛の形成を阻害してヘッジホッグシグナル伝達系を阻害する(⑧)。ニトロキソリンはBETブロモドメインタンパク質BRD4の働きを阻害してGLI転写活性を阻害する(⑨)。これらを組み合わせると、ヘッジホッグシグナル伝達系を阻害し、がん細胞の増殖を抑制し、細胞死を誘導できる。
● がん幹細胞とmTORとヘッジホッグ経路
がん幹細胞はがん組織中に少数(数%程度)存在しています。そして、がん幹細胞は正常な組織幹細胞と同様、特別な微小環境中に存在し、周りの細胞から分泌される液性因子などによって、多分化能の維持や分裂増殖が制御されていると考えられています。
がん幹細胞の自己複製や増殖を制御しているシグナル伝達系としてヘッジホッグ(Hedgehog)、mTORC1、Notch、Wnt-β-Cateninなどがあります。多くの種類のがん幹細胞ではmTORC1の活性とヘッジホッグシグナル伝達系の活性が非常に亢進しており、これらの経路を阻害すると抗がん剤治療の効果が高まることが報告されています。
この際、mTORC1とヘッジホッグのどちらか一方だけの阻害では十分な効果は得られず、両方のシグナル伝達系を同時に阻害した場合に、抗がん剤の効果を高め、がん幹細胞を消滅できると報告されています。ヘッジホッグシグナル経路は、様々ながんの発生や進展にも関与していることが明らかになっており、特にがん幹細胞の自己複製能の維持に重要な役割を担っています。 つまり、ヘッジホッグ・シグナル伝達系に関与するタンパク質の遺伝子の変異や発現亢進が組織幹細胞に起こるとがん幹細胞になってがんが発生するということです。
mTORC1はラパマイシンの標的分子として同定されたセリン・スレオニンキナーゼで、細胞の分裂や生存などの調節に中心的な役割を果たすと考えられています。がん細胞や肉腫細胞の多くにおいてmTORC1が活性化されており、mTORC1の阻害はがん細胞や肉腫細胞の増殖を抑制し、抗がん剤や放射線治療の効き目を高める効果や細胞死(アポトーシス)を誘導する効果が示されています。すでに幾つかのmTOR阻害剤が開発され、抗がん剤として使用されています。 mTORC1もがん幹細胞の自己複製や増殖や抗がん剤耐性に関与していることが報告されています。
つまり、ヘッジホッグ経路とmTORC1経路を同時に阻害すると、がん幹細胞の増殖や生存を阻害できるということです。
抗がん剤治療+ソニック・ヘッジホッグ阻害+mTOR阻害の3つを組み合わせると、がん幹細胞を消滅が可能となり、抗がん剤治療の 奏功率を高めることができると言えます。
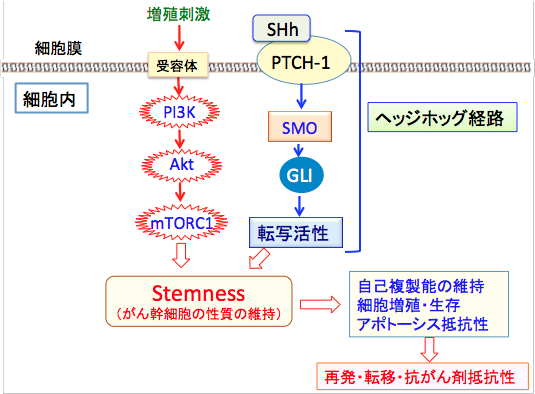
図: PI3K/Akt/mTORC1経路とヘッジホッグ(Hedgehog)経路は、自己複製能や不均等分裂などのがん幹細胞(Cancer Stem Cell)の性質を維持する上で重要は役割を果たしている。PI3K/Akt/mTORC1経路は増殖因子や栄養によって活性化され、セリン・スレオニンキナーゼのmTORC1を活性化して様々なタンパク質をリン酸化して活性化することによって細胞の増殖を促進する。ソニック・ヘッジホッグ・シグナル伝達系は細胞膜にある受容体のPatched-1 (PTCH-1)にソニック・ヘッジホッグ(SHh)が結合することによって開始され、smoothened(SMO)を介してシグナルが伝達され、転写因子の活性化によって細胞の増殖や分化を制御する。この2つの経路を阻害するとがん幹細胞の増殖を抑え、抗がん剤感受性を高めることが報告されている。